Qui a découvert l’ADN et l’ARN ? Episode 2 — Tout se complique!
La dernière fois (voir ici: ici), je t’ai laissé avec le chimiste d’origine suisse Friedrich Miescher, qui avait découvert en 1869 à Tübingen (actuelle Allemagne) dans le laboratoire de Félix Hoppe-Seyler une toute nouvelle substance biologique aux propriétés inattendues, qui ne correspondait à aucune de celles connues alors, et qu’il avait appelée nucléine.
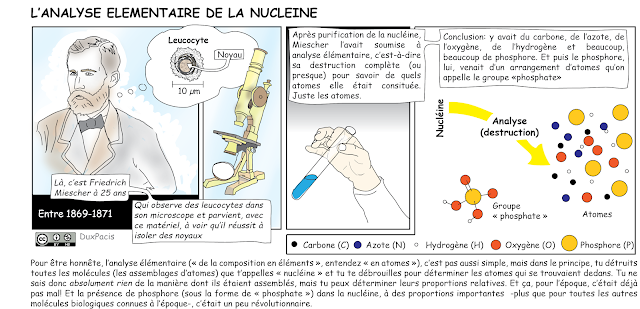
Après être parvenu à isoler des noyaux de leucocytes, il en avait fractionné (isolé) une molécule qu’il pensait être une nouvelle protéine, et qu’il avait nommée nucléine. Cette substance, il l’avait analysée à l’aide d’une technique nommée analyse élémentaire, et cela montrait que sa composition en atomes était très inhabituelle en regard de ce qui était déjà connu sur les protéines, en particulier qu’elle était très riche en phosphore[1]. Miescher pensait alors — comme il s’en confia à son oncle dans une lettre du 26 février 1869 — qu’il avait peut-être découvert une nouvelle classe de molécules biologiques[2]. C’était bel et bien le cas. Et quelle découverte ! Afin de bien comprendre pour quelle raison les résultats de Miescher étaient exceptionnels, et pourquoi Felix Hoppe-Seyler, son supérieur, voulait absolument vérifier ses travaux, il faut qu’on discute d’abord de ce que sont une analyse élémentaire et une formule brute, et surtout, que je te raconte ce qui était déjà connu à leur époque sur d’autres substances du monde vivant.
Eléments et atomes
C’est le chimiste Jöns Jacob Berzelius (1779-1848) qui, au XIXe siècle, popularisa le système de notation des atomes encore utilisé aujourd’hui[3], où chaque élément (atome) est codifié par une lettre: H pour l’hydrogène, C pour le carbone, N pour l’azote, O pour l’oxygène, S pour le soufre, P pour le phosphore, etc. Note qu’au XVIIIe siècle, on parlait volontiers de « nitrogène » (d’où le N pour le symbole de l’azote). Ce sont Antoine de Lavoisier (1743-1794), Louis Bernard Guyton de Morveau (1737-1816), Claude-Louis Berthollet (1748-1822) et Antoine de Fourcroy (1755-1809) qui introduisirent le nom « azote » en proposant leur nomenclature chimique en 1787[4]. Si le mot a été adopté en français, le pays de Lavoisier, celui de « nitrogène » est demeuré ailleurs (nitrogen en anglais et en allemand, par exemple). Comme témoignage de cet attachement, on peut remarquer qu’au XIXe siècle, on utilisait encore en France le symbole « Az » pour l’azote, au lieu de N, dans les ouvrages de chimie ou de physiologie (comme à l’époque de Miescher, ici[5] ou là[6]), usage qui s’est prolongé jusqu’au début du XXe siècle (exemple ici[7]).
Je te rappelle que l’existence des atomes était encore incertaine au XIXe siècle, mais que les chimistes, dont Berzelius, avaient toutes les raisons d’admettre leur existence depuis le siècle précédent; il en était de même, évidemment, des molécules, assemblages d’atomes.
Le
discours préliminaire du Traité
élémentaire de Chimie (1789)[8]
de Lavoisier commençait par une explication au lecteur de la raison pour
laquelle l’auteur n’aborderait pas de leçon sur les « éléments » en
tant qu’entités minimales théoriques, c’est-à-dire en tant que « briques
élémentaires »[9]
constituant la matière. Même si l’existence de corpuscules élémentaires
semblait être une hypothèse à la puissance explicative considérable[10],
la démonstration de leur existence et, surtout, la découverte de leur nature,
semblait très largement hors de portée. Ce que Lavoisier n’était pas prêt à
faire, c’était d’admettre a priori comme
vraie l’existence d’éléments fondamentaux insécables, qu’il s’agisse de
corpuscules ou de substances continues.
« On ne manquera pas d’être surpris de ne point trouver dans un Traité de Chimie, un chapitre sur les parties constituantes & élémentaires des corps: mais je ferai remarquer ici que cette tendance que nous avons à vouloir que tous les corps de la nature ne soient composés que de trois ou quatre élémens tient à un préjugé qui nous vient originairement des philosophes grecs. L'admission de quatre élémens qui, par la variété de leurs proportions composent tous les corps que nous connoissons, est une pure hypothèse imaginée long tems avant qu’on eût les premières notions de la ·Physique expérimentale & de la Chimie. On n’avoit point encore de faits & on formoit des systêmes; & aujourd'hui que nous avons rassemblé des faits, il semble que nous nous efforcions de les repousser, quand ils ne quadrent pas avec nos préjugés ; tant il est vrai que le poids de l’autorité de ces pères de la philosophie humaine se fait encore sentir, & qu'elle pèsera sans doute encore sur les générations à venir[11]. »
En fait, Lavoisier proposait une alternative opérationnelle, c’est-à-dire une définition de ce qu’il entendrait en tant que chimiste expérimentateur par « élément ». « Je me contenterai donc de dire que […] si au contraire nous attachons au nom d’éléments ou de principes des corps l’idée du dernier terme auquel parvient l’analyse, toutes les substances que nous n’avons pas encore pu décomposer par aucun moyen, sont pour nous des éléments ». Dans ce passage, Lavoisier posait que, si une substance pouvait être décomposée en entités plus simples, elle serait considérée comme un « composé » mais que si l’opérateur — le chimiste, donc — trouvait une substance qu’aucune méthode d’analyse (c’est-à-dire de destruction) ne permettait de décomposer en entités (il dit « principes ») plus simples, alors, il devrait la considérer comme « insécable » (qu’on ne peut pas découper), et l’appellerait « élément ». Une brique de base des opérations chimiques.
Cela correspond, au premier regard, à la définition que Démocrite donnait deux mille ans plus tôt de ses atomes spéculatifs, mais la différence est ici de taille. Lavoisier ne demande pas d’admettre a priori l’existence d’éléments fondamentaux qui correspondraient à l’idée de l’atome de Démocrite, purement conceptuelle, il dit simplement que si les moyens techniques ne parviennent pas à briser une substance, alors elle serait considérée comme un corps simple (non composé) qu’on pourrait envisager comme un élément (une entité fondamentale, une brique élémentaire, un principe) sans pour autant l’affirmer. L’important était que ce corps se comportât comme un atome du point de vue expérimental. Il ne suppose donc pas l’existence d’atomes, mais admet qu’on peut, en tant que chimiste, identifier des corps qui se comportent comme des atomes, et que l’expérience peut identifier et isoler. Il précise d’ailleurs ensuite[12]: «non pas que nous puissions assurer que ces corps que nous regardons comme simples ne soient pas eux-mêmes composés de deux ou même d’un plus grand nombre de principes, mais puisque ces principes ne se séparent jamais, ou plutôt puisque nous n’avons aucun moyen de les séparer, ils agissent à notre égard à la manière des corps simples, & nous ne devons les supposer composé qu’au moment où l’expérience & l’observation nous en auront fourni la preuve ». Contrairement à Démocrite, il n’affirme donc pas l’existence d’éléments fondamentaux corpusculaires, mais s’astreint à nommer comme tel des « choses » que l’expérience ne parvient pas à réduire. Un siècle plus tôt, le chimiste anglais Robert Boyle (1627-1691) avait proposé une définition semblable.
Un élément, donc, même au XIXe siècle, restait une entité que l’on ne pouvait pas décomposer par l’analyse. Depuis longtemps, on avait noté qu’en soumettant une substance à l’analyse, c’est-à-dire en la détruisant volontairement pour en séparer les constituants, on détectait toujours les mêmes éléments résultants et toujours dans les mêmes rapports relatifs. L’analyse de l’eau, par exemple, révélait toujours de l’oxygène et de l’hydrogène, comme l’avaient découvert en premier Lavoisier[13] et le physicien anglais Henry Cavendish[14]. Lavoisier avait ainsi démontré que l’eau n’était pas un élément, tel qu’affirmé par les grecs et par les alchimistes ; c’était un corps composé dont les éléments constitutifs s’échappaient sous forme de gaz, qu’il appelait « air inflammable » et « air pur ». Cavendish était parvenu, en mélangeant ces deux gaz, à reconstituer de l’eau[15], démonstration éclatante qu’elle était bel et bien formée de leur combinaison. L’ « air pur » fut renommé « oxygène » par Lavoisier[16] en 1778, et l’ « air inflammable » fut rebaptisé « hydrogène » (« qui génère de l’eau ») en 1783 par Lavoisier et Pierre Simon de Laplace, lorsqu’ils répliquèrent l’expérience de Cavendish[17]. Ces deux gaz, d’ailleurs, si on essayait de les décomposer, ne donnaient irrémédiablement que de l’oxygène et de l’hydrogène, respectivement, et on en conclut qu’il s’agissait donc d’éléments, de corps simples, qu’on nota H et O. L’eau, pour Lavoisier était alors un assemblage des deux éléments sous la forme d’un « composé » qu’il nota OH. C’était faux, mais gardons cette erreur de côté un petit moment, elle nous sera utile.
L’analyse élémentaire et la « signature » d’une substance
C’est ça, le principe d’une analyse élémentaire : détruire une substance pour en séparer les constituants élémentaires, ceux qu’on ne peut plus séparer davantage, et les identifier. Techniquement (ou de manière « pratique »), cela suppose, une dois la décomposition effectuée (par une opération physique ou chimique), de distinguer les nouveaux éléments formés les uns des autres et de les séparer. L’analyse élémentaire de l’eau conduisait toujours à l’identification de deux gaz aux propriétés distinctes: l’oxygène et de l’hydrogène. Aucun des deux ne pouvait plus être résolu en substances plus fondamentales par des moyens chimiques ou physiques, ce qui signifiait que ces deux gaz étaient des « corps simples », fondamentaux, qui entraient dans la constitution de l’eau. La décomposition de l’hydrogène par les moyens techniques de l’époque ne donnait apparemment que le même hydrogène ; celle de l’oxygène uniquement de l’oxygène.
L’idée proposée plus tard par le chimiste Jöns Jacob Berzelius était que pour chaque substance analysée, et dont on parvenait à identifier les éléments constitutifs, on associerait une formule — qu’on appelle aujourd’hui formule brute — qui résumerait leur contenu en éléments et dans quelles proportions relatives on les mesurait. Une sorte de signature ou de carte d’identité élémentaire (en éléments, en atomes) qu’on préciserait à côté de son nom. Dans le cas de Lavoisier, on noterait que l’eau est de formule brute OH (ou HO), signifiant qu’on y trouve autant de O que de H, c’est-à-dire qu’ils s’assemblent en proportion égale. Cela pourrait très bien être un seul atome O avec un seul atome H, mais aussi dix mille O et dix mille H, la proportion de 1 pour 1 (ou 3 pour 3, 10 pour 10 ou 1000 pour 1000) restant valable tant qu’on trouve autant de l’un que de l’autre. Pour le dioxyde de carbone, on trouvait toujours deux fois plus d’oxygène que de carbone, conduisant à la formule brute CO2 [18]. Bref, tu comprends que dans une formule brute, on ne connaissait pas le nombre réel d’atomes assemblés entre eux, mais seulement une proportion relative. Si on sait aujourd’hui qu’une molécule de CO2 contient deux atomes d’oxygène liés à un atome de carbone, à l’époque, on ne pouvait pas nécessairement l’affirmer, et la formule brute ne renseignait que sur le fait que pour un nombre donné d’atomes de carbone, deux fois plus d’atomes d’oxygène y étaient associés.
C’est Amedeo Avogadro (1731-1810) qui montra (1811) que si l’on admettait l’existence d’atomes (en tant qu’entités théoriques, cette fois), compte tenu des volumes de gaz hydrogène et oxygène à fournir pour produire de l’eau, ou des volumes de ces gaz produits après la décomposition de l’eau, l’eau n’était pas simplement composée d’H et d’O en proportions équivalentes, mais était une molécule contenant deux atomes d’hydrogène et un atome d’oxygène. Il y avait toujours deux fois plus d’hydrogène que d’oxygène[19][20]. La formule brute de l’eau (sa « signature » chimique) était donc écrite H2O — elle indiquait la présence de ces deux atomes et que la masse mesurée d’hydrogène était deux fois plus grande (H2) que celle de l’oxygène (O). De nos jours, les nombres de proportions sont écrits « en bas », en indice (H2O et non plus H2O)[21].
Note ici, chère lecteur, que la formule brute ainsi déterminée ne renseigne pas du tout sur la façon dont les atomes sont organisés entre eux et qu’il n’y figure donc aucun renseignement sur leur structure. Et pour cause, à cette époque, on n’avait pas encore déterminé les règles d’assemblage des atomes (leur valence). La formule brute n’avait donc qu’une visée purement descriptive de la composition en éléments, de notification de la signature d’un composé. Une sorte de nom abstrait qui rendait compte des connaissances expérimentales à son sujet.
Les nombres indiqués dans les formules brutes indiquaient des rapports de masse. Les nombres en exposant (aujourd’hui en indice) représentaient donc combien de fois la masse de tel atome était présente par rapport à tel autre (qui servait de référence). Quelle différence ?
Pour une petite molécule de glucose (un glucide), on avait déterminé qu’il y avait toujours une même masse d’oxygène que de carbone (rapport de 1), et toujours deux fois plus d’hydrogène que de carbone ou d’oxygène (rapports de 2). Le chimiste Justus von Liebig (1803-1873) avait ainsi écrit la formule brute du glucose comme CH2O (ou CH2O à l’époque ; note qu’on n’indique pas le 1, qui est sous-entendu pour C et O)[22]. D’ailleurs, puisque H2O apparaît, dans cette notation, à côté du carbone C, on avait appelé ce type de molécule des carbohydrates ou hydrates de carbone (du « carbone hydraté »), terme toujours en usage aujourd’hui.
En 1858, on parvint à déterminer qu’une molécule de glucose contenait en réalité 6 atomes de carbone (C), et donc 12 atomes d’hydrogène (H) et 6 atomes d’oxygène[23], fait qui a été prouvé maintes fois depuis. Il y a donc bien toujours autant de carbone que d’oxygène et deux fois plus d’hydrogènes que de carbones ou d’oxygènes, mais dans ce cas, comme on connaît la véritable composition d’une molécule de glucose, le nombre absolu d’atomes, on l’écrit C6H12O6 sans simplifier les rapports. En fait, si l’on connaît le nombre exact d’un seul des atomes dans une molécule, on peut déterminer tous les autres grâce aux rapports de masse.
Remarque : C’est un peu comme lorsque tu pèses deux boîtes de billes toutes identiques: si une boîte pèse 1 kg et l’autre 10 kg, tu sais qu’il y a dix fois plus de billes dans la seconde boîte que dans la première, même sans les compter. Tu ne sais pas combien il y en a, mais tu sais qu’il y en a dix fois plus dans l’une que dans l’autre. La simple hypothèse que toutes les billes sont identiques dans les deux boîtes (et donc que chaque bille a la même masse que les autres) te suffit à le savoir. Si tu parviens à savoir combien il y a exactement de billes dans n’importe laquelle des deux boîtes, tu peux alors déterminer automatiquement combien se trouvent dans l’autre. S’il y a 100 billes dans la boîte d’un kilo, alors comme la seconde est dix fois plus lourde, elle doit contenir 10 fois plus de billes, soit 1000 billes. C’est exactement le même principe ici.
Bref, retiens qu’une formule brute, à l’époque, c’était un résumé de ce qu’on savait des atomes constitutifs d’une substance et de leurs proportions relatives. En l’absence d’une détermination précise du nombre exact d’au moins l’un des atomes représentés, on ne pouvait pas connaître la « vraie » formule brute d’une substance, disons sa version « absolue » (comme le C6H12O6 du glucose), mais seulement une version relative (comme le CH2O du glucose).
L’analyse élémentaire des protéines
En 1869, on pratiquait l’analyse élémentaire depuis des décennies, déjà[24], et elle s’améliorait toujours davantage. Les protéines, les lipides, les glucides (sucres) simples avaient déjà été analysées de cette manière, et on avait établi des formules brutes qui résumaient les atomes qu’on y trouvait, et en quelles proportions, ce qui permettait de classer les molécules en fonction de ces compositions. Ce sont aussi ces analyses qui, en premier lieu, avaient permis de les différencier entre elles, en plus de leurs propriétés physico-chimiques différentes (solubilité dans l’eau, propension à coaguler à la chaleur, goût, etc.).
Le chimiste Gerardus Johannes Mulder (1802-1880) avait conduit de telles expériences sur des protéines, et avait conclu qu’elles possédaient toutes une formule brute sinon identique, du moins extrêmement proche[25][26]: C400H620N100O120 avec, parfois un ou deux atomes de soufre et de phosphore (C400H620N100O120P1S1 et C400H620N100O120P1S2). C’était faux, mais ces formules brutes (en proportions) ont le mérite de montrer qu’on savait déjà que les protéines étaient riches en carbone, hydrogène, azote, oxygène et qu’elles comportaient très peu de soufre (1 atome de soufre pour 400 carbones dans le premier exemple) ou de phosphore (1 atomes de phosphore pour 400 carbones). Justus von Liebig montra que Mulder s’était trompé, mais obtint le même genre de formules brutes, avec énormément de carbone, d’hydrogène, d’azote et d’oxygène, peu de soufre et peu ou pas de phosphore[27]. Un ouvrage de 1864 du chimiste Paul Schutzenberger[28], résume bien les connaissances de l’époque de Miescher sur ces entités biochimiques. Il classe les protéines dans les « matières azotées plastiques » (« plastiques » dans le sens « changeantes, diverses »), dénotant bien cette propriété de richesse en azote (p. 25-38) que les glucides et les lipides ne présentaient pas.
Sans savoir combien d’atomes de carbone exactement une seule protéine contenait, on ne pouvait pas déterminer le nombre réel d’atomes constitutifs de ces entités chimiques. Ceci resta un débat jusqu’aux années 1940[29]. Les formules brutes affichaient donc des proportions et pas un nombre absolu d’atomes comme ce serait le cas aujourd’hui.
L’analyse
élémentaire, pour te donner une idée, n’est pas chose aisée. Il s’agit de
soumettre une substance à la destruction par des moyens physiques tels que la
chaleur, ou chimiques comme le traitement par des acides puissants pour en séparer
les constituants atomiques. Cela suppose donc de pouvoir détruire lesdites substances,
c’est-à-dire toutes les molécules identiques qui forment ladite substance, et
cela de manière homogène à chaque fois que l’analyse est faite et de pouvoir détecter et déterminer quels
produits de dégradation sont formés.
Car si l’on peut détruire une molécule à l’aide de moyens physico-chimiques, en réalité on ne sépare pas cette molécule en une myriade d’atomes isolés, car ces derniers peuvent à leur tour réagir entre eux et former de nouvelles molécules, idéalement plus simples — on parle de produits de réaction.
Il faut donc des techniques permettant d’identifier ces produits de réaction, déterminer de quels atomes ils sont formés, et remonter ensuite à la composition de la molécule de départ, en sachant que, lors de la dégradation de la substance de départ, ses produits de dégradation peuvent tout à fait réagir avec les gaz de l’air dans l’espace réactionnel, mais aussi avec les acides ou autres produits utilisés pour la « détruire ». C’est à la condition de connaître la façon dont ces substances « parasites » (gaz, acides, éventuellement contaminants du milieu réactionnel) se comportent qu’on peut remonter à une formule brute de la substance de départ.
De plus, il faut aussi que la substance analysée soit assez pure — sans autres substances contaminantes. C’est d’ailleurs parce que les protéines utilisées par Mulder n’étaient pas pures qu’il trouvait une même formule brute pour toutes celles qu’il analysait. Il déterminait en réalité une formule brute « moyenne » de toutes les protéines qu’il analysait en même temps, sans le savoir.
La nucléine de Miescher
Friedrich Miescher avait caractérisé la nucléine avec l’analyse élémentaire et déterminé que sa composition en atomes ne correspondait pas à celles des glucides (de formue brute de type CH2O ou parfois CHO), des lipides déjà décrits tels que les acides gras découverts en 1813 par Chevreul[30][31], ni à celle des protéines alors connues. La nucléine contenait du carbone, de l’oxygène, de l’hydrogène et de l’azote, comme les protéines — raison pour laquelle on pensa un temps qu’il s’agissait d’une protéine — mais jamais de soufre (S). On y trouvait, en revanche, beaucoup de phosphore (P), un atome rare dans les « matières albuminoïdes » (protéines). C’est pour cette raison que Hoppe-Seyler était méfiant. D’autres, comme Mulder, s’étaient fourvoyés et avaient formulé sur la nature des protéines des hypothèses qui s’étaient avérées fausses à cause de problèmes de pureté de leurs échantillons, et c’était surtout cela que craignait Hoppe-Seyler. Miescher était jeune (25 ans, donc) et inexpérimenté à ses yeux, et donc probablement exposé à des erreurs triviales telles que celles-là. De plus, à l’époque, seuls deux types de composés biologiques étaient connus pour contenir du phosphore: les protéines — et seulement occasionnellement — et la lécithine, riche en phosphore, qui pouvait très bien contaminer l’échantillon de Miescher. Hoppe-Seyler fut d’ailleurs le premier à purifier la lécithine et à l’étudier (il s’agit d’un mélange de phospholipides, constituants des membranes cellulaires)[32].
Evidemment, l’âge de Miescher n’avait absolument rien à voir avec la pertinence de ses résultats rigoureux et tout fut confirmé par Hoppe-Seyler[33] et quelques autres chercheurs de son laboratoire (1852-1900)[34]. En plus de confirmer l’existence de l’incroyable nucléine dans les cellules de pus, ils montrèrent qu’elle existait également dans le jaune d’œuf et dans la levure de bière[35]. Miescher parvint à démontrer que le phosphore présent en grandes quantités dans la nucléine ne provenait pas de la lécithine, ni d’une contamination par une autre molécule souvent présente dans l’eau: le phosphate (HPO4-, un dérivé de l’acide phosphorique H2PO4). Après la destruction (analyse) de la nucléine, il obtenait bien du phosphate, mais ce dernier était manifestement déjà lié à la nucléine, c’est-à-dire entrant réellement dans sa composition. C’est de ce « groupement » (petit édifice d’atome) que provenait le phosphore.
Qu’est-ce que la nucléine ?
On se situe maintenant après 1870 et, donc, après l’annexion de l’Alsace et de la Moselle par la Prusse. Hoppe-Seyler et toute sa troupe déménagent dans une nouvelle université, à Strasbourg. Louis Pasteur y avait déjà fait quelques travaux de chimie avant l’annexion et l’empereur Guillaume II (Kaiser Wilhelm II) souhaitait donner à cette université une modernité et ampleur scientifique internationales[36]. En 1872, un étudiant en médecine originaire de Rostock (Nord de l’actuelle Allemagne) appelé Albrecht Kossel (1853-1927) vint à l’université de Strasbourg, où il suivit les cours de chimie de Hoppe-Seyler[37]. En 1877, Hoppe-Seyler l’embarqua dans son équipe où le jeune médecin se mit en tête de trouver la nucléine un peu partout et de mieux le caractériser, chimiquement parlant. Il commença ses investigations en 1878[38]. Les techniques évoluaient et, dans le contexte strasbourgeois où de grands chimistes de l’Empire travaillaient maintenant, les possibilités d’études, d’analyses, etc. devenaient nettement plus favorables. Il commença par améliorer les techniques de collecte de la nucléine en utilisant la levure de bière comme source biologique[39][40] et publia ses résultats dès 1879 et 1880, à peine un an, donc, après le début de ses travaux. On parvint à établir une formule brute pour la nucléine[41]: C₂₉N₄₉N₉O₂₂P₃.
Malgré les efforts considérables de Miescher pour démontrer la composition étrange de la nucléine, et en dépit des expériences de confirmation de Hoppe-Seyler et ses collaborateurs en 1871, l’idée que la nucléine fût « autre chose » qu’une protéine restait controversée, voire rejetée par beaucoup de chercheurs de l’époque. Pas parce que c’était une hypothèse audacieuse, mais surtout parce que la nucléine réagissait quand même avec des colorants supposément spécifiques des protéines[42], ce qui suggérait qu’elle était soit contaminée par des protéines, soit était une protéine, bien que très étrange.
L’analyse de la nucléine par Kossel fut conduite en utilisant des techniques d’analyse plus douces, permettant de libérer non pas de minuscules fragments, mais de plus gros fragments, moins dégradés, sous la forme donc de molécules plus grandes. Ce faisant, il découvrit qu’en plus du phosphate, l’analyse libérait des molécules riches en azote. Il isola (de 1879 à 1880) ce qu’on appelle des purines (ces molécules riches en azote), dont la xanthine et l’hypoxanthine. Les purines étaient déjà connues depuis longtemps (la première fut découverte en 1776 par Scheele) et sont présentes dans beaucoup d’autres substances biologiques. La caféine et la théobromine (caféine du thé) sont par exemple aussi des purines, trouvées dans les plantes, et qui étaient décrites depuis le début du XIX siècle[43]. Si Kossel découvrit la présence de purines dans la nucléine, un autre chercheur appelé Jules Piccard avait déjà isolé en 1874 quelques uns de ces composés de noyaux de sperme de saumon[44], alors qu’il travaillait à Leipzig avec Miescher[45] — qui avait quitté le laboratoire de Hoppe-Seyler, je te le rappelle… le monde est petit ! Kossel confirmait donc que ce scientifique ne s’était pas trompé.
La nucléine, donc, contenait des purines. Beaucoup de gens pensaient que ces composés entraient dans la constitution des protéines (dont on ne savait presque rien non plus, rappelle-toi), mais Kossel n’était pas convaincu[46][47], bien qu’il ne disposât pas réellement de preuves ou d’arguments. Une intuition, dirons-nous. Il publia, en 1881, un livre intitulé Recherches sur la nucléine et ses produits de dégradation[48], dans lequel il résuma toutes ces connaissances, accumulées depuis son arrivée à Strasbourg. Il continua donc à étudier la nucléine. Néanmoins, il quitta Strasbourg et le laboratoire de Hoppe-Seyler en 1883 pour un poste à l’université de Berlin.
Les bases nucléiques
Pour étudier la nucléine, Kossel avait besoin de beaucoup de matériel de départ. Et la levure, c’était bien joli, mais ce n’était pas un organisme animal (à cette époque, on pensait encore que les levures, des champignons unicellulaires, étaient affiliées aux plantes), et pour étudier la nucléine dans un contexte plus proche de ses intérêts médicaux, il choisit de changer de modèle. Rappelle toi que la quantité de matériel à analyser était déjà un gros problème pour Miescher, qui avait consciencieusement récupéré des bandages imprégnés de pus, afin d’en collecter les leucocytes. Kossel avait besoin de beaucoup plus de matériel de départ, afin d’extraire plus encore de nucléine à des fins d’analyses plus poussées. Il se mit en cheville avec un abattoir local, récupéra des centaines de kilos de pancréas de bœuf et de thymus[49] d’où il s’acharna à extraire son bonheur à l’aide de techniques dérivées de celles utilisées par Miescher[50]. Tu vois qu’à l’époque, pour avoir un peu d’acide nucléique, il fallait ce qu’il fallait ! De nos jours, il suffit d’un écouvillon dans le nez, quelques frottements, et on peut récupérer assez d’acide nucléique pour faire tout un tas de tests avec ce fifrelin. Ça te donne une idée de l’amélioration considérable des techniques de (bio)chimie depuis cette époque — et j’ai envie de dire heureusement, parce que sinon, imagine le genre de prélèvement qu’il eût fallu te faire pour espérer peut être détecter le SARS-CoV-2.
Grâce à cela, il parvint à identifier en 1885 une nouvelle purine issue de la dégradation de la nucléine extraite du pancréas de bœuf — mais il réussit aussi à le faire avec la nucléine de la levure — l’adénine[51]. Ce nom, il le forgea à partir du grec adeno, signifiant « glande », car il l’avait trouvée en premier dans une glande (le pancréas). En réalité, il avait isolé plusieurs purines, dont l’une était déjà connue : la guanine, un composé découvert en 1844 et nommé ainsi en 1846 par Julius Bodo Unger (1819-1885)[52][53]. Piccard, qui avait aussi détecté les purines dans des préparations de nucléine, avait également déjà détecté la guanine[54]. Les travaux de Kossel sur l’adénine, entre 1886 et 1888, lui permirent d’en établir la formule brute et les propriétés chimiques[55][56]. Il démontra que l’hypoxanthine (purine) identifiée auparavant dans la nucléine était probablement un produit de dégradation de l’adénine qu’il venait de découvrir[57], ce qui impliquait qu’en réalité, la nucléine ne contenait probablement pas d’hypoxanthine, mais de l’adénine.
C’est alors que Richard Altmann[58], pathologiste et histologiste de Leipzig, parvint en 1888 à extraire la nucléine à un degré de pureté jusqu’alors inégalé, en éliminant notamment plusieurs protéines qui y étaient associées. Grâce à cela ce dernier put prouver que la nucléine n’était effectivement pas une protéine: elle n’en avait ni la composition ni, les propriétés physico-chimiques habituelles. Et elle ne se colorait pas avec les réactifs de détection des protéines. C’était bel et bien quelque chose d’autre, de nouveau, plus acide que les protéines connues, insoluble dans les acides et les solvants, et qui avait les mêmes propriétés que la mucine (un type de protéine) mais n’en avait pas la composition. Altmann finit ainsi par renommer la nucléine « acide nucléique »[59][60]. Note bien que personne ne savait comment les atomes s’organisaient dans l’ « acide nucléique », à part le fait qu’on y trouvait des groupements « phosphate ». Ce changement de nomenclature initié par Altmann et qui fut largement accepté, contraria Miescher, qui se sentit dépossédé de sa « chère nucléine », comme le raconte Dahm[61].
Albrecht Kossel put travailler sur cette nucléine[62] — rebaptisée acide nucléique. Après son hydrolyse et analyse des produits de dégradation, il parvint à confirmer en 1891 la présence de phosphate (HPO4-), qui donnait à la molécule sont caractère acide, mais aussi de grandes quantités de guanine et d’adénine avec, en prime, une molécule qui avait les propriétés d’un carbohydrate[63] (si si, rappelle-toi, c’est ainsi que les travaux de Justus von Liebig avaient conduit à appeler les sucres). Il y avait donc, en plus, une histoire de sucre (glucide) là-dessous. Les choses se compliquaient. Dans les deux années suivantes, avec ses étudiants, il mit au point de nouvelles méthodes d’extraction et de purification de l’acide nucléique, et ils parvinrent ensemble à identifier deux molécules de plus entrant dans la composition de cette substance décidément complexe. Il s’agissait de deux nouvelles molécules appartenant à la famille des pyrimidines, la thymine (car issue de nucléine extraite du thymus) dont ils publièrent la découverte en 1893, et la cytosine en 1894[64][65].
En 1894, donc, on savait grâce à Kossel et ses étudiants que la dégradation de la nucléine — acide nucléique — libérait du phosphate, un sucre non-identifié et quatre autres molécules, appelées bases nucléiques, deux purines, l’adénine et la guanine, et deux pyrimidines, la cytosine et la thymine. Les formules brutes de ces bases nucléiques furent déterminées, et leur richesse relative en azote leur valut le nom de bases azotées. C’est Emil Fischer (1852-1919), l’un des plus grands chimistes de l’époque (aussi passé par Strasbourg), qui détermina leur structure entre 1886 et 1902 [5]. Une grande avancée !
Le tout, constata Kossel, était assemblé sous la forme de « quelque chose » de gros[66][67], mais qu’il ne put l’identifier. A ce stade, il me faut te dire — on le sait aujourd’hui[68] — que leur acide nucléique n’était pas de l’ADN pur, mais un mélange de ce qu’on appelle aujourd’hui l’ADN et l’ARN. Cela aura de l’importance pour la suite (épisode 3).
Résumons : grâce à Albrecht Kossel, on savait que l’ « acide nucléique » contenait un sucre non-identifié, du phosphate et au moins 5 bases azotées (l’adénine, la guanine, la cytosine, la thymine et parfois de l’uracile). Mais on n’avait aucune idée de la manière dont tous ces éléments s’assemblaient —ni du fait qu’il y avait en réalité 2 molécules: ADN et ARN. Il me faut donc te prévenir, cher lecteur, qu’on était encore loin de la double hélice que tu connais. Et on est encore tout aussi loin de rencontrer ceux et celles qui ont compris que le support de l’hérédité, c’est l’ADN — et pas les protéines.
Donc, pour résumer, on sait maintenant (1889 à 1906) que « l’acide ribonucléique » est constitué d’un assemblage encore indéterminé de phosphate, d’un sucre non-identifié et de bases azotées. J’espère que ça t’a plu. On verra la suite une prochaine fois. Je te mets les références pour que tu aies de quoi lire si jamais ça t’inspire. A un de ces jours pour la suite !
[1] Dahm, R. (2008) Discovering DNA : Friedrich Miescher and the early years of nucleic acids research, Hum Genet, 122, 565-581.
[2] Dahm, R. (2008) La première découverte de l’ADN, Pour la Science, 371.
[3] Kyle, R. A., Steensma, D. P. Jöns Jacob Berzelius – A Father of Chemistry. Mayo Clinic Proceedings. 2018, Vols. 93 (5): e53–e54. Le lien suivant permet aussi d’avoir des informations: https://www.sciencehistory.org/historical-profile/jons-jakob-berzelius
[4] Le texte était le suivant: Dans ces circonstances nous n’avons pas cru pouvoir mieux faire que nous arrêter à cette autre propriété de l’air phlogistiqué, qu’il manifeste si sensiblement, de ne pas entretenir la vie des animaux, d’être réellement non-vital, de l’être, en un mot, dans un sens plus vrai que les gaz acides & hépatiques qui ne font pas partie comme lui de la masse atmosphérique , & nous l’avons nommé azote, d’ l’a privatif des grecs & et zwή vie. Dans Méthode de nomenclature chimique, par MM. de Morveau, Lavoisier, Bertholet et de Fourcroy, 1787, p. 36.
[5] Schutzenberger, Paul (1864) Chimie appliquée à la physiologie animale, à la pathologie et au diagnostic médical, Masson & Fils, Paris. Disponible sur Gallica: https://gallica.bnf.fr/ark:/12148/bpt6k5790965m.r=Chimie%20appliqu%C3%A9e%20%C3%A0%20la%20physiologie%20animale%2C%20%C3%A0%20la%20pathologie%20et%20au%20diagnostic%20m%C3%A9dical?rk=21459;2
[6] Troost, Louis (1867) Précis de Chimie, 2e édition, 1867 lien sur Gallica: https://gallica.bnf.fr/ark:/12148/bpt6k97998098/f19.item.r=chimie%20and%20(prOx:%20%22analyse%22%201%20%22%C3%A9l%C3%A9mentaire%22)
[7] Haller, M. A. (1906) Les récents progrès de la chimie, Paris. Lien : https://gallica.bnf.fr/ark:/12148/bpt6k90660b/f6.item
[8] Lavoisier, A. (1789) Traité élémentaire de chimie, discours préliminaire, p. xv, Cruchet, Paris.
[9] Bernadette Bensaude-Vincent, Isabelle Stengers, Op. cit, p. 44.
[10] Bernadette Bensaude-Vincent, Isabelle Stengers, Op. cit, p. 41.
[11] Lavoisier, A. Op. Cit.Discours préliminaire, p. xv
[12] Lavoisier, A. (1789) Op. cit., discours préliminaire, pp. xvii-xviij.
[13] Avant Lavoisier et Cavendish, les chimistes considéraient l’eau comme un élément, c'est-à-dire une substance fondamentale, non-destructible en éléments plus fondamentaux. Leur découverte fut donc une petite révolution. L’eau n’était pas un élément, mais un « composé », un assemblage d’oxygène et d’hydrogène. On peut trouver la description de l’expérience de Lavoisier (conduite de 1783 à 1785) dans son Traité élémentaire de chimie (Paris : Cuchet, 1789.) (Chap. VIII, p. 87), où il cite le mémoire dans lequel il avait rendu compte de ses conclusions.
[14] West JB. Henry Cavendish (1731-1810): hydrogen, carbon dioxide, water, and weighing the world. Am J Physiol Lung Cell Mol Physiol. 2014 Jul 1;307(1):L1-6. doi: 10.1152/ajplung.00067.2014.
[15] Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. pp. 183–191.
[16] Lavoisier, Antoine (1778) Considérations générales sur la nature des acides. Mémoires de l’Académie des sciences mais aussi dans Lavoisier, Antoine (1777) Mémoire sur la combustion en général. Mémoires de l’Académie des sciences.
[17] Emsley, John (2001). Op. cit.
[18] Berzelius, Jacob. (1813),Op. Cit..
[19] Avogadro, A. Op. Cit.
[20] Fernandez, Bernard, Op. cit.
[21] Berzelius, Jacob. (1813),Op. Cit..
[22] Schindler, S. Justus von Liebig. Chemistry 2023, 5, 1046–1059. https://doi.org/10.3390/chemistry5020071
[23] La date est citée dans beaucoup d’articles de revue historique, mais je n’ai pas retrouvé la référence originale. Je l’ajouterai si j’y parviens.
[24] Fritz Pregl, Op. cit.
[25] Tanford C, Reynolds, J. Nature's robots. Oxford New York : Oxford University Press, 2001. ISBN-10 : 019860694X
[26] Vickery, H. B. and Osborne, T. B. (1928) A review of hypotheses of the structure of proteins. Physiological Reviews, Vol. 8, pp. 393–446
[27] Tanford C, Reynolds, J. Op. cit.
[28] Schutzenberger, Paul (1864) Op. cit.
[29] Tanford C, Reynolds, Op. cit.
[30] Chevreul, M. E. (1813). Sur plusieurs corps gras, et particulièrement sur leurs combinaisons avec les alcalis. Annales de Chimie, t. 88, p. 225-261.
[31] Chevreul, M. E. Recherches sur les corps gras d'origine animale. Levrault, Paris, 1823
[32] E. Baumann and A. Kossel. (1895) Zur Errinnerung an Felix Hoppe-Seyler. Zeitschrift für physiologische Chemie, Bd. xxi. Une version adaptée en anglais est disponible ici : https://en.wikisource.org/wiki/Popular_Science_Monthly/Volume_53/August_1898/The_Life_and_Work_of_Felix_Hoppe-Seyler#cite_note-1
[33] Hoppe-Seyler, F. (1871) Ueber die chemische Zusammensetzung des Eiters. Hoppe-Seyler's Med.-chem. Unters., 1871, 486.
[34] Plosz (1871) Ueber das chemische Verhalten der Kerne der Vogel- und Schlangenblut Korperchen. Hoppe-Seyler's Med.-chem. Unters., 1871, 463.
[35] Miescher, F. (1871) Die Kerngebilde im Dotter der Huhnereis. Hoppe-Seyler's Med. chem. Unters., 502.
[36] Voir : https://chimie.unistra.fr/faculte/historique/ et http://www.lamaquinaecrire.com/une-universite-allemande-a-strasbourg-luniversite-de-lempereur/
[37] Jones, ME. Albrecht Kossel, a biographical sketch. Yale J Biol Med. 1953 Sep;26(1):80-97.
[38] Jones, ME, Op. cit., p. 82.
[39] Kossel, A. (1879) Ueber das Nuclein der Hefe, I. Zschr. physiol. Chem., 3, 284.
[40] Kossel, A. (1880) Ueber das Nuclein der Hefe, II. Zschr. physiol. Chem., 4, 290.
[42] Olby, R. (1969) Cell chemistry in Miescher’s day, Med His. 13(4):377-82.
[43] Fry, M. (2016) Landmark experiments in molecular biology, Academic Press; 1st edition, p. 25.
[44] Piccard, J.(1874) Ueber Protamin, Guanin und Sarkin, als Bestandtheile des Lachs-sperma. Ber. Deut. chem. Ges., 1874, 7, 1714.
[45] Fry, M. (2016) Op. cit., p. 24.
[46] Jones, ME. Op. cit., p. 83.
[47] Kossel, A. Nobel lecture, 12 décembre 1910. Le passage du discours de Kossel concernant ces faits est le suivant: “Earlier it was generally accepted that guanine and other similar substances originated from the protein molecule and Miescher thought that these bodies perhaps arose from protamine, while Piccard put forward the idea that “they pre-existed along with it in the salmon sperm”. Knowledge of their origin from nucleic acid, which was unexpected and, to start with, ran up against active opposition, gave at the same time an understanding of particular phenomena for which an explanation had been lacking; e.g. it had been noted that in leukaemia, guanine and related substances were present in large amounts in the blood. Now in this disease it is typical that the non-nucleated red cells are replaced by elements containing nuclei, but these latter break down in large numbers and accordingly the body fluids are overwhelmed with the decomposition products of nucleic material. Hence the bases just mentioned, or their very closely related transformation products, occur in large amounts in the body fluids. Also the contradiction mentioned previously, which appeared in the supposed presence of nucleic material in egg yolks and in milk, was now solved. A more accurate investigation showed that these elements, which because of their external behaviour and phosphorus content had previously been considered as nucleins, possess a chemical structure of different type. The nitrogen-rich building blocks as I have called them, are completely absent – thus they really do not belong to the group of the true nucleic substances and form a special class.” Lien: https://www.nobelprize.org/prizes/medicine/1910/kossel/lecture/
[48] Kossel, A. (1881) Untersuchungen über die Nukleine und ihre Spaltungsprodukte (Recherches sur les nucléines et leurs produits de dissociation/dégradation), 1881.
[49] Lorch, M. (2023), Op. cit.
[51] Kossel, A. (1885) Ueber das Adenin. Ber. Deut. chem. Ges., 1885, 18, 1928.
[52] Unger, B. Das Guanin und seine Verbindungen (Guanine and its compounds). Ann. Chem. Pharm. 1846, 59, 58– 68, DOI: 10.1002/jlac.18460590108.
[53] Ce brave Julius l’avait isolé du guano d’oiseaux accumulé sur les rochers en bord de mer. Normalement, là, tu te demandes certainement pourquoi un type est allé analyser la composition chimique du guano en 1844? Parce qu’il existait une industrie florissante du guano en cette période de révolution industrielle et agricole et qu’il était récolté, stocké et vendu une fortune comme fertilisant. Du coup, on voulait tout connaître du guano pour savoir ce qui lui donnait ses propriétés fertilisantes. Guanine, ça vient de « guano » (avec le suffixe « ine »).
[54] Kossel, A. Nobel lecture, 12 décembre 1910. Le passage du discours de Kossel est le suivant: “From [the nucleic acid] I succeeded in obtaining a number of fragments which could be dissolved out of the molecule in part even by gentle chemical action and which were recognizable by a quite special concentration of nitrogen atoms. Here four nitrogen-containing groups are present together: cytosine, thymine, adenine, guanine. One of these four bodies, guanine, has been known for some time in various animal tissues and was found by Piccard for example in the spermatozoa of salmon, although indeed this investigator had no suspicion that it had any genetic relationship with the nucleins.” Lien: https://www.nobelprize.org/prizes/medicine/1910/kossel/lecture/
[55] Kossel, A.: Ueber eine neue Base aus dem Thierkorper. Ber. Deut. chem. Ges.,1885, 18, 79.
[56] Kossel, A. (1888) Ueber das Adenin. Zschr. physiol. Chem., 1888, 12, 241.
[57] Kossel, A. (1886) Weitere Beitrage zur Chemie des Zellkerns. Zschr. physiol. Chem.,1886, 10, 248.
[58] Sa biographie est disponible sur Wikipédia: https://fr.wikipedia.org/wiki/Richard_Altmann. Tu y apprendras qu’Altmann n’a pas seulement participé à la découverte et à la caractérisation de l’ADN, mais qu’il a aussi remarqué et étudié ce qu’on appelle aujourd’hui les mitochondries.
[59] Altmann, R. (1889) Ueber Nucleinsauren. Arch. Anat. Physiol., Lpz., 524.
[60] Dahm, R. (2008), Hum Genet, 122, 565-581 mais aussi Frixione, E, Ruiz-Zamarripa, L (2019) The "scientific catastrophe" in nucleic acids research that boosted molecular biology, J Biol Chem, 15;294(7):2249-2255
[61] Dahm, R. (2008) Discovering DNA : Friedrich Miescher and the early years of nucleic acids research, Hum Genet, 122, 565-581
[62] Jones, ME, Op. cit., p. 85.
[63] Kossel, A.: Ueber die chemische Zusammensetzung der Zelle. Arch. Anat. Physiol., Lpz., 1891, 181.
[64] Kossel, A. and Neumann, A.: Ueber das Thymin ein Spaltungsprodukt der Nucleinsäure. Ber. Deut. chem. Ges., 1893, 26, 2753.
[65] Kossel, A. and Neumann, A.: Darstellung und Spaltungsprodukte der Nucleinsäure (Adenylsaure). Ber. Deut. chem. Ges., 1894, 27, 2215.
[66] Dahm, R. (2008) Discovering DNA : Friedrich Miescher and the early years of nucleic acids research, Hum Genet, 122, 565-581.
[67] Frixione, E, Ruiz-Zamarripa, L (2019) The "scientific catastrophe" in nucleic acids research that boosted molecular biology, J Biol Chem, 15;294(7):2249-2255.
[68] Thess, A, Hoerr, I, et al. (2021) Historic nucleic acids isolated by Friedrich Miescher contain RNA besides DNA, Biol Chem, 402(10), 1179-1185




Aucun commentaire:
Enregistrer un commentaire