Le monde
de l’infiniment petit — Episode 2 : Où l’on va discuter des atomes et de leur organisation intime
Pour l’épisode 1, c’est par là.
Les premiers modèles de l’atome, dits classiques, suggéraient qu’en raison de la charge négative que portent les électrons, et des charges positives portées par le noyau, les électrons devaient suivre un mouvement circulaire autour du noyau, selon une « orbite » décrite par les équations de l’électrostatique. C’était, en quelque sorte une analogie avec les systèmes planétaires, comme ceux que tu as pu voir dans les schémas de l'épisode 1.
Toutefois, ce modèle, conformément à l’électromagnétisme classique de Maxwell, impliquait qu’en raison de son mouvement circulaire, l’électron devait nécessairement perdre de l’énergie sous forme de rayonnement électromagnétique et, ce faisant, se rapprocher fatalement du noyau, et y tomber. Or, nous savons bien, puisque nous sommes bien là pour les observer – et parce qu’accessoirement, nous en sommes constitués – que les atomes sont stables. Il n’expliquait pas non plus pour quelle raison les atomes ne peuvent absorber ou émettre que des quantités d’énergie discrètes, bien déterminées. Pire encore, les expériences montraient que les électrons, contrairement à des planètes, ne pouvaient pas se trouver n’importe où autour du noyau, et, surtout, ne pouvaient exister que sur des « trajectoires » elles aussi quantifiées. Le modèle classique a donc été abandonné au profit d’une nouvelle théorie, plus à même d’expliquer ces faits, le modèle quantique. Désolé, ces schémas simples avec des électrons qui orbitent autour du noyau sont faux. Toutefois, sache qu'on les utilisera quand même, parce que même erronés, ils sont bien pratiques. Il faudra simplement se rappeler qu'ils ne sont qu'une vue de l'esprit, une sorte de facilité pédagogique.
Petites révisions de l’épisode précédent
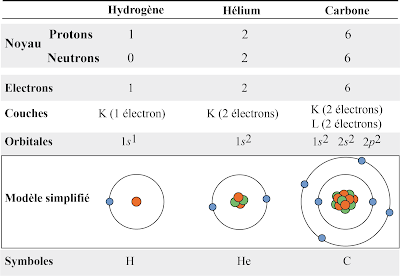
Un atome c’est donc un noyau composé de nucléons tels que les protons et les neutrons, et qui porte donc des charges positives. Selon le nombre de protons et de neutrons qu’on trouve là-dedans, on peut distinguer les noyaux entre eux, et donner des noms différents à ces entités : un seul proton c’est un noyau d’hydrogène, deux protons et deux neutrons, c’est un noyau d’hélium, six protons et six neutrons, c’est un noyau de carbone, etc. Mais, la matière est neutre (non chargée), tout simplement parce que d’autres particules sont en interaction avec le noyau, les électrons, qui eux possèdent chacun une charge négative. Il y a, dans un atome neutre, toujours autant d’électron autour du noyau qu’il y a de protons à l’intérieur dudit noyau. Donc, autour d’un noyau d’hydrogène (un seul proton, et donc une seule charge positive), on trouve un électron (une seule charge négative) ; c’est ça qu’on appelle un atome d’hydrogène, auquel on attribue le symbole H. Tous les machins qui se baladent dans l’univers et qui sont constitués d’un seul proton autour duquel circule un seul électron sont des atomes d’hydrogène. De même, tous les trucs qui possèdent six protons, six neutrons et autour desquels se baladent six électrons, on les appelle des atomes de carbone.
Orbitales et couches électroniques
Seulement voilà, là ça va se compliquer. Toutes ces particules — protons, neutrons et électrons — ne se baladent pas au hasard car elles s’influencent les unes les autres en raison de leurs charges ou des particules d’interaction qu’elles peuvent s’échanger entre elles (voir l'encart dans l'épisode 1). Ainsi les protons et les neutrons sont « collés » entre eux et forment une structure qu’on appelle le noyau. L’organisation interne du noyau est une chose complexe qu’on ne discutera pas ici (mais tu pourras trouver des informations pertinentes sur ce site ou encore là si jamais ça te tracasse; d'ailleurs, sache que tu peux aussi trouver des infos vulgarisées sur les atomes par là).
Les électrons, eux, subissent l’influence des protons, et à cause de leurs charges respectives (protons positifs et électrons négatifs), c’est la force électromagnétique qui régit leurs influences respectives et leurs mouvements. Les électrons sont donc maintenus autour du noyau tant qu’aucune force ne les en arrache. Plus il y a de protons, et plus il y a d’électrons et lorsqu’ils sont aussi nombreux, tous ces machins chargés négativement s’organisent en couches successives.
Dans le modèle quantique, le mouvement des électrons et leur position autour du noyau ne sont pas des notions aussi simples que dans le modèle classique. Tout ce qui touche au monde atomique ou subatomique est régi par les lois de la mécanique quantique. Dans ce monde de l’infiniment petit, toutes ces particules (atomes, électrons, neutrons, protons, et les autres) se comportent à la fois comme des corpuscules de matière et comme des ondes mais… ne sont aucun des deux. Cette propriété étrange et néanmoins essentielle a pour conséquence des contraintes sur l’organisation d’un atome et ses constituants, en particulier sur le comportement des électrons « piégés » autour du noyau. L’une d’entre elles est, par exemple, que les électrons ne peuvent pas se trouver n’importe où autour du noyau, mais dans des zones bien précises (discrètes), qu’on appelle des orbitales. Elles ne correspondent pas à des orbites circulaires, comme dans le modèle classique (« planétaire ») mais à des zones au sein desquelles un électron dans un état donné — c’est-à-dire avec une certaine énergie — a le plus de chances de se trouver, lorsqu’il se trouve autour du noyau. Ainsi, la position d’un électron ne peut être représentée que par un nuage de probabilité de position au sein duquel il peut exister. Ce nuage représente l’orbitale de l’électron. Il existe plusieurs types d’orbitales délimitées dans l’espace, dont la forme dépend des énergies des électrons qui leur son associées. Il en existe plusieurs types selon la géométrie qu’elles adoptent : les orbitales de type s, de type p, de type d et de type f, etc.
Comme les orbitales sont quantifiées (elles ont des positions définies dans l’espace entourant le noyau), les énergies qui correspondent à ces positions sont, elle aussi, quantifiées (elles ne peuvent prendre que certaines valeurs et jamais de valeurs « intermédiaires »).
Autre étrangeté, l’électron ne se trouve pas en un point précis de l’orbitale, mais peut exister partout en même temps dans l’orbitale en vertu du principe de superposition des états qui régit cette théorie, d’où l’existence de ce nuage dans lequel l’électron est dit délocalisé.
Chaque orbitale peut contenir un nombre fini (précis) d’électrons. Ainsi, les orbitales de type s (de l’anglais sharp) sont un nuage sphérique qui peut contenir 2 électrons, les orbitales de type p (principal) sont des lobes qui peuvent contenir 6 électrons, les orbitales de type d (diffuse) des lobes et des tores qui peuvent contenir 10 électrons, et les orbitales de type fsont des multi-lobes contenant jusqu’à 14 électrons.
L’atome d’hydrogène : le cas le plus simple
Prenons l’atome d’hydrogène. Autour de son noyau (un seul proton), il y a un seul électron. Dans l’état d’énergie le plus bas possible (qu’on appelle l’état fondamental), cet électron se trouve dans une orbitale 1s (dans la couche n°1, ou K) – ce qu’on note 1s1, lire « 1 électron dans l’orbitale de type s de la couche n°1 ». Toutefois, même s’il ne possède, a priori pas d’autres orbitales, parce qu’il n’a pas d’autres électrons, il faut savoir que, dans l’atome d’hydrogène, si l’électron ne se trouve pas dans son état fondamental – s’il acquiert de l’énergie –, il peut créer et passer sur des orbitales « plus élevées », c’est-à-dire plus éloignées du noyau. Ainsi, s’il acquiert la quantité d’énergie (discrète) nécessaire pour passer sur une orbitale supérieure, il passera dans une orbitale 2s. S’il acquiert encore de l’énergie, il passera sur l’orbitale 2p, puis 3s, 3p et ainsi de suite. Ces orbitales ont toutes des formes différentes (que tu peux voir ici).
Les autres cas, plus compliqués
L’atome suivant du tableau de Mendeeïev, l’hélium (He), possède un noyau composé de deux neutrons et deux protons (donc, deux charges positives), autour duquel on trouve… deux électrons ! Ils se trouvent tous les deux dans la fameuse orbitale 1s (couche K) qui peut en contenir deux. Ce fait est noté 1s2 (comprendre « 2 électrons dans l’orbitale s de la couche n°1 »). Elle est donc remplie entièrement. On dit qu’elle est complète.
Pour le carbone, qui possède six électrons, deux se trouvent dans l’orbitale 1s (1s2) deux dans l’orbitale 2s (2s2) et les deux derniers dans l’orbitale 2p (2p2). L’orbitale 2p n’est donc pas « remplie », puisqu’elle peut en contenir 6.
![]() Ainsi, plus le nombre d’électrons
augmente, et plus le nombre d’orbitales augmente en « couches »
successives de plus en plus éloignées du noyau. Il y a donc des atomes qui ne
possèdent qu’une seule orbitale (1s
dans la couche K) comme l’hydrogène
(H) et l’hélium (He), qui en possèdent deux (1s et 2s) comme le lithium
(Li), ou encore trois (1s, 2s et 2p) comme le carbone (C) ou l’azote (N). La progression continue
pour les atomes qui possèdent davantage d’électrons : 1s, 2s,
2p, 3s, 3p, 3d, 4s,
4p, 4d, 4f, etc… Plus les
électrons sont nombreux, et plus ces orbitales se remplissent.
Ainsi, plus le nombre d’électrons
augmente, et plus le nombre d’orbitales augmente en « couches »
successives de plus en plus éloignées du noyau. Il y a donc des atomes qui ne
possèdent qu’une seule orbitale (1s
dans la couche K) comme l’hydrogène
(H) et l’hélium (He), qui en possèdent deux (1s et 2s) comme le lithium
(Li), ou encore trois (1s, 2s et 2p) comme le carbone (C) ou l’azote (N). La progression continue
pour les atomes qui possèdent davantage d’électrons : 1s, 2s,
2p, 3s, 3p, 3d, 4s,
4p, 4d, 4f, etc… Plus les
électrons sont nombreux, et plus ces orbitales se remplissent.
La matière est constituée... de vide.
Le nuage électronique se trouve très loin du noyau. La matière, et en particulier les atomes, sont constitués à 99,99 % de … vide ! Le diamètre moyen du noyau atomique est d’à peu près d’un ordre de grandeur de d ≈ 10-15 m (un million de milliardième de mètre), et celui de l’atome (noyau + nuage électronique) de l’ordre de d ≈ 10-10 m (dix milliardièmes de mètre). Il y a donc entre les deux un facteur 105 (cent mille) de différence. Pour prendre une analogie, si le noyau avait la taille d’une orange (à peu près 10 cm de diamètre), l’atome serait cent mille fois plus vaste (10-2 x 105), c’est à dire à peu près un kilomètre de diamètre ! Si on considère non plus le diamètre, mais le volume, on se rend compte que la différence de volume entre un noyau, et le nuage électronique est en moyenne d’un facteur 1015 (soit un million de milliards) !!! La matière est donc principalement constituée du vide qui sépare les noyaux des électrons.
Conclusion
Voilà. Pour l'instant, on va s'arrêter là. La prochaine fois, on verra comment ces électrons, tout autour du noyau, déterminent les propriétés chimiques des atomes: pourquoi un atome d'hydrogène ne réagit pas comme un atome de carbone, lui-même différent de l'oxygène? Et puis, d'ailleurs, c'est quoi un ion ? Pourquoi certains atomes peuvent-ils être chargés ? On parle bien d'anions (négatifs) ou de cations (positifs), alors que jusque là, on disait que la matière est neutre. Et puis, d'ailleurs, comment ça se fait que les atomes peuvent absorber de la lumière, ou en émettre (fluorescence, phosphorescence) ? Mine de rien, ces petits détails nous permettront de comprendre ensuite comment les atomes peuvent s'assembler entre eux et former des structures plus grandes, les molécules.


Aucun commentaire:
Enregistrer un commentaire