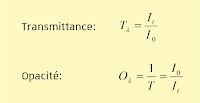La spectrophotométrie permet d’étudier
les propriétés de la matière et d’avoir accès à des informations sur le monde
microscopique. En laboratoire, elle permet également de déterminer la
composition et/ou la concentration d’un échantillon. La Loi de Beer-Lambert est
l’un des outils permettant de mesurer la concentration d’un (ou plusieurs) composés en
solution.
D’où vient la loi de Beer-Lambert ?
La loi dite de Beer-Lambert, parfois
aussi appelée Loi de Beer-Lambert-Bouguer, a été établie suite aux travaux
indépendants de trois savants : August
Beer (1825-1863)[1],
physicien, chimiste et mathématicien allemand originaire de Trèves (actuelle
Allemagne), Jean-Henri Lambert
(1728-1777)[2], mathématicien et
philosophe né à Mulhouse (cité-Etat indépendante à cette époque) et Pierre Bouguer (1698-1758)[3], mathématicien et
physicien français (né au Croisic). Tous les trois
ont contribué à la compréhension du comportement de la lumière lorsqu’elle
traverse des milieux non-transparents.
Même si Beer, Lambert et Bouguer ont permis d’élaborer les équations décrivant
ce phénomène, son explication, au niveau microscopique leur était
inconnue ; elle n’a été proposée qu’au XXe siècle.
Quel est le principe de la loi de
Beer-Lambert ?
Prenons un montage expérimental simple
(Fig. 1). Une source lumineuse (laser) émet un faisceau
lumineux caractérisé par une intensité I0,
qu’on appelle intensité incidente
(entrante). Ce faisceau lumineux passe à travers une cuve, et, en sortie du
montage, un détecteur est chargé de mesurer l’intensité du rayon sortant, qu’on
appelle l’intensité transmise (celle
qui passe) It. Le but est
de déterminer si toute ou seulement une partie de la lumière passe ou non,
en comparant l’intensité I0
entrante et l’intensité It
sortante (transmise).
 |
Figure 1: Montage expérimental. Un laser
produit un faisceau lumineux d’intensité I0,
dite intensité incidente. Ce faisceau traverse un milieu quelconque (placé dans
une cuve) et un détecteur mesure l’intensité du faisceau sortant It. On peut alors déterminer
la fraction de lumière sortante par rapport à celle entrante en calculant It/I0. En le multipliant par 100, on obtient le pourcentage
de la lumière envoyée sur l’échantillon et qui parvient jusqu’au détecteur.
Dans le cas n°1, le milieu est parfaitement
transparent, ce qui induit que toute
la lumière a traversé l’échantillon. Dans ce cas It = I0,
donc 100 % de la lumière traverse. Les deux autres cas (2, 3) se placent dans
des conditions où le milieu traversé est de plus en plus opaque, ce qui conduit
à une transmission de la lumière de plus en plus faible. |
Si
It = I0, c’est-à-dire que l’intensité en sortie est la même
que celle d’entrée, alors cela signifie que toute la lumière passe à travers la cuve (le milieu,
l’échantillon) et on dit que 100 % de la lumière ont été transmis ou que 0
% a été absorbé (retenu, dévié, etc.). Dans ce cas, le milieu, l’échantillon ou
la cuve sont dits transparents.
Lorsque la lumière passe à travers un milieu quelconque (air, gaz, verre,
liquide, etc.), on mesure souvent une intensité It (transmise) inférieure à l’intensité incidente I0, car il n’est pas
transparent. On dit qu’une partie de la lumière a été absorbée par le milieu et donc que ce milieu est opaque ou absorbant.
On
définit la transmittance T comme la fraction de lumière capable
de traverser le milieu, c’est-à-dire comme le rapport entre l’intensité de
lumière sortante (It) et
l’intensité entrante (incidente, I0).
Multipliée par 100, on mesure donc le pourcentage de lumière transmise,
soit :
L’opacité (O) correspond à l’inverse de
la transmittance (I0/It, et donc quantifie la
capacité du milieu à empêcher la
transmission de la lumière). Elle est beaucoup moins utilisée. L’origine
de l’absorption de la lumière
Lorsque
qu’un faisceau de lumière traverse un milieu non transparent, son intensité
diminue, et on mesure une intensité sortante plus faible. Cette
« perte » d’intensité, l’absorption,
peut avoir plusieurs origines qui sont bien connues aujourd’hui.
 |
| Figure 2: L'absorption et la diffusion des photons
par les molécules/atomes. La figure du haut présente très schématiquement le
principe de l’absorption. Ici, la source lumineuse (laser) émet des photons
possédant une énergie telle qu’ils peuvent
être absorbés par les électrons des molécules présentes dans le milieu
qu’ils traversent. Lorsqu’ils sont absorbés, ils font passer les électrons dans
un état d’énergie plus élevé (état excité). Ces photons ne sont donc plus
« libres ». La molécule ayant absorbé un photon grâce à l’un de ses
électrons est également dite « dans un état excité ». En sortie, le
détecteur ne mesure que les photons qui n’ont pas été absorbés (40 % de ceux
qui sont entrés dans le milieu). La transmittance est donc de 40 %. La figure du bas présente le principe de la
diffusion. Ce phénomène est indépendant de la capacité des molécules/atomes à
absorber ou non un photon. Ici, lorsqu’un photon entre en collision avec une
molécule/atome, il peut être renvoyé dans une autre direction (diffusé). En
sortie, le nombre de photons détectés est donc plus faible. Ici, encore, la
transmittance est de 40 % (seulement 40 % des photons sont passés sans être
diffusés). |
L’absorption des photons –
Les photons peuvent effectivement être absorbés par les électrons des molécules ou les atomes présents dans
le milieu traversé. Cette propriété, bien expliquée par la mécanique quantique,
tire son origine du fait que les électrons répartis autour des noyaux d’atomes,
ou encore ceux présents dans les liaisons covalentes, peuvent absorber un photon, acquérir l’énergie
qu’il transporte, et passer dans un état d’énergie plus élevé. Cette absorption
n’a lieu que si l’énergie du photon
incident (celui qui arrive) est au
moins égale à celle associée à l’orbitale de l’électron ; si ce n’est
pas le cas, l’électron n’absorbe pas le photon incident, et il peut continuer
sa course. Ainsi, si les photons incidents possèdent une énergie (voir Encart 1) telle qu’elle permet leur absorption par les
électrons présents à la surface d’un atome ou d’une molécule du milieu traversé,
et seulement dans ce cas, alors ils sont absorbés. Au niveau macroscopique de
l’expérience, le détecteur en sortie du montage détectera donc moins de
photons, et donc une intensité lumineuse plus faible. S’ils ne sont pas
absorbés, parce que les propriétés des molécules dans le milieu ne le
permettent pas, ou parce qu’ils ne possèdent pas l’énergie requise, alors il
n’y aura pas d’absorption.

La diffusion des photons – Un autre phénomène peut affecter les
photons incidents lorsqu’ils traversent un milieu. Ils peuvent être diffusés
(voir Encart 2). La diffusion désigne un phénomène
physique pour lequel, lorsqu’un photon rencontre un atome, une molécule ou une
particule plus grande (poussière, etc.), il peut entrer en collision avec eux
et finalement être dévié de manière élastique (il rebondit) sans que ses
propriétés ne soient altérées (longueur d’onde inchangée, etc.). Le résultat de
cette collision élastique (diffusion) est que les photons changent de
trajectoire. Donc, lorsqu’un faisceau lumineux traverse un milieu non
transparent (contenant des atomes, des molécules ou autres), une partie des
photons qui le constituent peuvent être dispersés
(subir ce phénomène de diffusion) et être renvoyés dans toutes les directions.
Comme le détecteur ne mesure que les
photons dont la trajectoire est rectiligne (ceux qui traversent le milieu en ligne droite), alors il mesurera une
quantité de photons sortants plus faible que ceux qui sont entrés, et donc une
intensité transmise It
plus faible que celle d’entrée I0.
Les deux phénomènes (absorption et
diffusion) peuvent se produire en même temps lorsque la lumière traverse un
milieu (échantillon) et contribuer tous les deux à la diminution de la
transmittance.

L’importance de la longueur d’onde
Comme
nous venons de le voir, les photons peuvent être absorbés par les électrons
lorsqu’ils possèdent une énergie suffisante pour provoquer un saut quantique,
c’est-à-dire faire passer ces électrons d’un niveau d’énergie à un autre, plus
élevé. Cela signifie que l’absorption ne se produit que si la longueur d’onde –
et donc l’énergie (voir Encart 1) – des photons
est adéquate. En d’autres termes, pour qu’un composé présent dans notre cuve (Fig. 1) ait un effet d’absorption, il faut que la longueur
d’onde de la lumière soit telle qu’elle véhicule une énergie suffisante pour
provoquer le saut quantique d’un ou plusieurs électrons présents dans l’atome
ou la molécule qui le constituent. De plus, les liaisons covalentes, les
doubles liaisons et les doublets non-liants des molécules, eux aussi constitués
d’électrons, peuvent aussi absorber des photons. La longueur d’onde du photon
nécessaire pour exciter ces électrons dépend du contexte dans lequel ils se
trouvent.
 |
| Figure 3 | |
Prenons une molécule telle que le
G-250, de la famille des triméthylméthanes qui est utilisée pour détecter les
protéines dans la fameuse méthode de
Bradford que tu as certainement déjà
vue quelque part si tu es étudiant.e en biologie. Cette molécule possède
plusieurs cycles phényles (Fig. 3) comportant des
double-liaisons délocalisées, très riches en électrons, ainsi que plusieurs
formes tautomériques (alternatives) différentes. Cela signifie que les
électrons des double-liaisons peuvent se déplacer sur une grande surface. Pour
ces raisons, le G-250, lorsqu’il est libre en solution, peut absorber les
photons visibles (entre 400 et 800 nm). Si l’on prend le montage de la Fig. 1, on peut utiliser une source lumineuse (laser) pour
laquelle on peut régler la longueur d’onde. Si, dans la cuve, on place une
solution de G-250 à une concentration fixe, et qu’on éclaire l’échantillon avec
ce laser, mais cette fois à plusieurs longueurs d’onde (la Fig. 3 en
présente 27 différentes), on constate un phénomène intéressant. Le G-250 n’absorbe pas tous les types de
photons, et, en plus, absorbe plus efficacement certains d’entre eux. Pour
les longueurs d’onde proches de 800 nm (lumière rouge), on observe que la transmittance est quasiment de 100
%, ce qui signifie que la lumière passe quasiment intégralement à travers
l’échantillon. Autrement dit, les photons possédant une longueur d’onde de 800
nm ne sont pas absorbés par le G-250.
Plus on réduit la longueur d’onde, et plus la transmittance diminue, ce qui
signifie que l’absorption des photons par le G-250 augmente, avec un maximum à
651 nm. Une fois cette longueur d’onde franchie, si l’on continue à diminuer l, la
transmittance augmente à nouveau (l’absorption diminue), avec un minimum autour
de 600 nm, puis, elle diminue (l’absorption augmente) à nouveau à mesure qu’on
s’approche d’un nouveau pic d’absorption (transmittance la plus faible) vers
467 nm. Lorsque l diminue
encore, l’absorption diminue à nouveau (la transmittance augmente). Ainsi, le
G-250 peut absorber toute une gamme de photons de l différentes,
mais il existe des l préférentielles, pour lesquelles l’absorption est maximale, centrées
autour de 651 et 471 nm. Ce sont les longueurs d’ondes qui correspondent aux
énergies les plus favorables pour que les photons incidents soient absorbés par
les électrons du G-250.
Commentaire de la figure 3: La figure présente la molécule de G-250. La seconde partie présente le même montage qu'à la figure 1, dans 4 cas différents. Le même échantillon de G-250 en solution (liquide, donc) est éclairé par 4 lumières différentes, avec 4 longueurs d'onde différentes. Dans chaque cas, la lumière transmise est mesurée (transmittance et absorbance représentées). Si l'on effectue ce travail pour tout un tas de longueurs d'ondes différentes, on peut représenter l'absorbance (ou la transmittance) en fonction de la longueur d'onde, et obtenir ce qu'on appelle un spectre d'absorbance.
Note bien que la transmittance (la fraction de
lumière qui a traversé l’échantillon)
est maximale lorsque l’absorption est minimale. Il
est par ailleurs nettement plus intuitif de raisonner en prenant en compte l’absorption, car c’est elle qui t’informe
du fait que les photons sont effectivement absorbés. On peut alors utiliser l’opacité (l’inverse de la
transmittance). L’opacité (O) augmente lorsque l’absorption par le
composé augmente. Note bien que l’absorption
des photons (et donc l’opacité ou la transmittance) par un composé dépend
entièrement de la longueur d’onde de la lumière choisie. Donc, on mesure
toujours la transmittance ou l’opacité à la longueur d’onde d’absorption maximale.
On note donc toujours la transmittance et l’opacité avec, en indice, la
longueur d’onde à laquelle l’expérience est effectuée (Tl, Ol). Dans notre
cas, pour analyser, détecter ou doser le G-250, on utiliserait la longueur
d’onde à 467 nm, qui correspond à l’absorbance maximale en lumière visible (ici jaune).
Bien entendu, il existe d’autres zones
d’absorption dans les UV ou dans les infra-rouges, mais je ne les ai pas été
représentées.
Pour résumer, la quantification de
l’absorption de la lumière à une longueur d’onde donnée par un échantillon peut
être faite grâce à la transmittance (Tl), l’opacité (Ol,
l’inverse de la transmittance, 1/T)
ou par l’absorbance (Al, qui est le logarithme décimal de
l’opacité ou de l’inverse de la transmittance)
L’effet de la concentration et de
l’épaisseur traversée
 |
| Figure 4 |
Lorsque la lumière traverse un milieu
non vide, elle peut être diffusée ou absorbée par les composés qui s’y
trouvent. La probabilité qu’elle subisse ces effets est d’autant plus grande
que le nombre de composés présents dans le milieu est important ; cela
implique que, plus la concentration
d’un ou de plusieurs composés est élevée, plus ils occupent le volume de
milieu, et plus la lumière sera diffusée et/ou absorbée, conduisant à
l’atténuation du faisceau en sortie de montage. Donc, It est généralement d’autant plus faible – par rapport à
I0 – que la concentration
de composés est élevée. Inversement, plus la concentration de composé est
faible, moins la lumière sera diffusée et/ou absorbée. C’est assez intuitif,
finalement.
De même, pour une concentration de
composé(s) fixe, si la distance que la lumière doit parcourir dans le milieu
augmente, alors la probabilité qu’elle soit diffusée et/ou absorbée augmente,
conduisant à une diminution de It
par rapport à I0 ;
inversement, si la distance à parcourir diminue, la probabilité de diffusion
et/ou absorption diminue, ce qui impacte moins It. Une manière de formuler les choses est de dire que
la transmittance diminue (la lumière passe moins) si la concentration augmente
et si la distance à parcourir augmente. Autrement dit, La transmittance est inversement corrélée à la
concentration et à la distance parcourue.
La question est maintenant de savoir si
cette relation est linéaire ou non : Est-ce que la transmittance diminue
proportionnellement avec l’augmentation de la concentration ou non ?
Commentaire de la figure 4: Effet de la concentration et de la distance
parcourue sur la transmittance. Plus la
concentration est élevée, plus la probabilité que les photons rencontrent un
composé (molécules, etc.) et soient absorbés est grande. Donc l'absorbance augmente si la concentration augmente. De même, plus la
distance est grande, et plus la probabilité d’absorption est grande. Si on augmente la longueur de l'échantillon, donc, l'absorbance sera plus grande. Le
phénomène est similaire pour la diffusion.
Transmittance ou absorbance ?
Est-ce que la transmittance mesurée varie
linéairement avec (proportionnellement à) la concentration ? Cette
question peut paraître anodine, mais elle est en réalité importante dans un
contexte expérimental, car il est beaucoup plus facile de travailler avec des
relations linéaires qu’avec d’autres types de relations. Pour quelle
raison ? Parce que, s’il existe une relation linéaire entre des quantités,
on peut utiliser des règles de trois (produits en croix) pour les calculs, et,
surtout, les représentations (des droites) sont facilement exploitables pour
effectuer des extrapolations (prédictions).
 |
| Figure 5 |
Beer,
Lambert et Bouguer avaient bien remarqué que, plus la concentration d’un
échantillon est importante, et plus il est opaque, c’est-à-dire que moins il laisse passer la lumière. Prenons
l’exemple d’un composé X quelconque,
qui possède un pic d’absorption maximal à 595 nm. Cela signifie qu’à cette
longueur d’onde, les photons du laser ont une énergie adéquate pour être
absorbée par des électrons de X, et qu’en plus, comme il s’agit d’un pic, que
cette énergie est optimale. C’est
donc ce réglage du laser que nous allons choisir pour l’expérience. En
utilisant le montage de la Fig. 1, on mesure qu’en
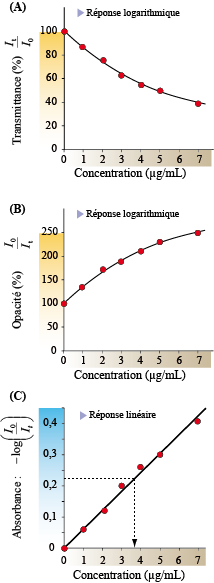
l’absence de X, la lumière n’est pas absorbée, et la transmittance est de 100 %
(1.0 si on ne prend pas les pourcentages). Si l’on augmente progressivement la
concentration de X, (dans la Fig. 5, elle est de 1, 2,
3, 4, 5 et 7 µg/mL), on observe que la transmittance diminue progressivement
(la lumière passe moins), conformément à ce que nous avons déjà discuté. Si l’on construit un graphique représentant la
transmittance mesurée pour chaque concentration (Fig. 5A),
on s’aperçoit qu’elle ne diminue pas linéairement avec la transmittance. Il n’y a pas de relation linéaire entre la
transmittance et la concentration. C’est la même chose avec l’opacité
(l’inverse de la transmittance) (Fig. 5B). En revanche,
lorsqu’on utilise le logarithme négatif
de la transmittance (–logT =
–log(It/I0), ce
dernier est proportionnel à la
concentration du composé (Fig. 5C).
De
ce fait, –log(It/I0)
est proportionnel à la concentration. Il existe entre eux une relation linéaire (Fig. 5C).
Pour cette raison, c’est ce logarithme qu’on utilise. Il porte le nom d’absorbance. La Fig. 5C montre que l’absorbance augmente lorsque la
concentration de l’échantillon augmente. Comme elle est linéaire (proportionnelle), cela signifie qu’une
concentration deux fois plus élevée d’un composé aura une absorbance deux fois plus élevée ; autrement dit, doubler la
concentration double l’absorbance, et ainsi de suite. L’absorbance est donc
beaucoup plus intuitive à utiliser, et c’est la raison pour laquelle elle est
largement répandue.
De manière générale, il y a une
relation linéaire en l’absorbance, la distance parcourue par
la lumière dans l’échantillon, et la concentration de l’échantillon.

Où Al
est l’absorbance, c la concentration
de l’échantillon et l la
longueur parcourue par la lumière dans l’échantillon.
Le facteur de proportionnalité el est le coefficient
d’extinction ; el est spécifique à chaque composé. Il s’agit bien d’une
équation de droite de type y = ax (où y = A, et où a= ell est une constante, puisque l est
généralement fixe dans un appareil de mesure, et que el est fixe pour un composé donné ;
où x=c, puisque c’est la concentration qu’on fait varier
expérimentalement).
Quand
peut-on utiliser la loi de Beer-Lambert ?
i) Le
milieu constitué d’un composé absorbant la lumière ne doit pas être trop concentré. Pourquoi ? Parce que sinon, il est évident que toute la lumière pourra être soit diffusée, soit absorbée, soit les deux, à partir d'une certaine concentration: on ne mesurera alors plus rien et on n'obtiendra aucune information. La "concentration idéale" n'existe pas, et doit se déterminer expérimentalement. On verra ça une autre fois.
ii) Le
composé à étudier ne doit pas réagir
avec la lumière utilisée pour déterminer son absorbance. Autrement dit, il ne faut pas que le composé étudié change en interagissant avec la lumière, et, surtout, qu'il change d'une façon qui rend son absorption de la lumière différente !
iii) La
lumière traversant le milieu doit être monochromatique, c’est-à-dire n’avoir
qu’une seule longueur d’onde bien définie (notée l), ou, de manière équivalente, une fréquence unique (notée n,
avec n
= c/l, où c est la vitesse de la lumière dans le vide).
iv) le
milieu doit être homogène (ses
constituants doivent être distribués de manière homogène dans la solution ou le
gaz, c’est-à-dire qu’ils soient distribués de la même manière dans tout le milieu).
Utiliser la Loi de
Beer-Lambert
Les
spectrophotomètres usuels disposent d’un laser émettant un rayon lumineux de
longueur d’onde l
contrôlée, d’intensité I0
connue, et d’un détecteur mesurant l’intensité transmise It, et ils donnent directement la valeur de l’absorbance Al (donc la valeur de –log(I0/It). Les cuves utilisées ont toutes une longueur l connue et standardisée (généralement 1 cm).
Donc, avec cette valeur de Al, il est possible de déterminer la
concentration d’un échantillon si l’on connaît le coefficient d’extinction el du composé analysé.
Si l’on mesure une absorbance donnée lors d’une expérience,
comme :
alors :
Si le coefficient el a des unités en M-1.cm-1
(donc aussi en L.mol-1.cm-1) et que l est en centimètres, alors la
concentration [c] déterminée est en M
(mol.L-1). Si le coefficient el a des unités en L.g-1.cm-1,
et que l est en centimètres, alors la
concentration c déterminée est en
g/L.
Concentration
vs. Quantité
La
mesure de l’absorbance représente une information sur la concentration. C’est
ce que dit la Loi de Beer-Lambert. On sait que la concentration est reliée à la
quantité (molaire, n ou la masse m) par les relations suivantes :

La Loi de Beer-Lambert se formule de la manière
suivante :

En prenant en compte les formulations
de la concentration, et en remplaçant c
par ces deux expressions, on obtient deux équations :
Donc on peut également déterminer la
quantité n ou la masse m d’un composé présent en solution, en
connaissant son coefficient d’extinction el, sa masse molaire M, et le volume de l’échantillon v, à partir de l’absorbance Al que
l’on mesure. En réarrangeant les
équations précédentes :
Et
s’il y a plusieurs composés en solution ?
Que se passe-t-il si plusieurs composés
sont présents en même temps dans le même échantillon ? On peut démontrer
que les absorbances sont additives, ce qui signifie que
chaque composé présent, s’il absorbe à la même longueur d’onde que les autres,
contribue proportionnellement à sa concentration et à son coefficient
d’extinction, à l’absorbance globale. On peut le formuler de la façon
suivante : l’absorbance totale est
la somme des absorbances individuelles, ou, mathématiquement :
Plus simplement: chaque composé qui absorbe apporte sa contribution à l'absorbance globale.
Conclusion
Un de ces jours, je t'expliquerai comment on utilise la loi de Beer-Lambert dans des cas plus pratiques, ses limites, ses contraintes.
[1][1]Beer, A. (1852) Bestimmung der Absorption des rothen Lichts in farbigen
Flüssigkeiten, Annalen der Physik und Chemie, vol. 86,
p. 78-88.
[2] Lambert,
J. H. (1760) Photometria, sive de mensura et gradibus
luminis, colorum et umbrae,
Sumptibus Vidae Eberhardi Klett, 1760.
[3] Bouguer,
P. (1729), Essai
d'optique sur la gradation de la lumière,
Paris, Claude Jombert, p. 16-22.