Le monde
de l’infiniment petit — Episode 1 : Où l’on va discuter de la matière
L’univers
autour de nous est rempli d’objets de toutes sortes, et ils sont tous composés
de matière. Scientifiquement, la
matière désigne tout corps qui possède une « réalité tangible »,
c’est-à-dire dont les propriétés, les états, les transformations sont
accessibles à l’observation et à la mesure. Dans la nature, la matière peut
exister sous plusieurs états,
c’est-à-dire plusieurs degrés de cohérence : l’état solide (le plus ordonné), l’état liquide, l’état gazeux,
l’état plasma. Il en existe encore
quelques autres, plus exotiques.
Les
rochers, les pierres, l’océan (l’eau), l’air que nous respirons, le Soleil, les
nébuleuses lointaines, les galaxies, tous ces objets sont constitués de matière.
Elle apparaît comme extrêmement diverse et, déjà dans l’Antiquité, les
philosophes grecs s’interrogeaient sur sa nature, sur ses constituants, sur sa
composition. Intuitivement, on pourrait croire qu’il y a une infinité de
constituants fondamentaux de la matière qui expliquent l’infinité d’objets
matériels que nous voyons.
Démocrite le rieur
et les atomes philosophiques
Prends une pierre dans ta main.
Elle possède une masse, et est tangible, et donc, tu la considères comme réelle. De quoi est-elle
constituée ? La réponse la plus évidente serait de dire qu’elle est
composée, tout simplement, de pierre. Mais cette pierre, de quoi est-elle
faite ? Pour répondre à cette question, coupe la pierre en deux. Aussitôt,
tu obtiens deux morceaux de pierre,
et chacun de ces morceaux représente une
moitié de pierre. Si tu répètes la même opération sur une moitié de pierre,
tu vas aussi obtenir deux morceaux, dont chacun sera un quart de la pierre de départ. Continue encore, et tu obtiendras
des morceaux qui représenteront 1/8e, 1/16e, 1/32e,
1/64e et, au bout de la dixième répétition, 1/1024e de
pierre. En continuant encore et encore, à la 20e coupure, tu auras
1/1 048 576e de pierre. Les morceaux deviennent ridiculement
petits, mais imaginons que tu puisses encore continuer, encore et encore, tout
en étant encore capable de « voir » s’il reste de la
« pierre ». Peux-tu continuer indéfiniment ? Y a-t-il un moment
ou les coupures ne seront plus possibles ? Dans le premier cas, la matière
serait divisible à l’infini, de manière continue, et c’est la raison pour
laquelle on parle de matière continue.
Dans le second cas, s’il existe un moment à partir duquel tu ne peux plus
continuer à découper « la pierre », et que tu tombes sur une entité
insécable, un constituant fondamental, élémentaire, alors cela signifierait que
la matière est discontinue — ou, dit
en termes mathématiques, discrète. Là,
tu aurais quelque chose qu’on pourrait appeler un corpuscule. C’est ce que les
Grecs appelaient un atome (de atomos, « insécable »). Ce débat
philosophique sous la forme d’une expérience de pensée a duré des siècles.
L’histoire
est connue. Les atomes, c’est une idée qu’on peut faire remonter à la Grèce
Antique, et en particulier à Démocrite d’Abdère (460 à 370 av. J.-C), celui qui
fut à l’origine de cette expérience de pensée. Ses écrits ne sont pas parvenus
jusqu’à nous, si ce n’est sous la forme de fragments, et c’est surtout à
d’autres auteurs qu’on doit la mémoire de ses textes, souvent confondus avec
ceux de son maître, Leucippe (Ve siècle av. J.-C), premier fondateur de
l’atomisme[1].
Démocrite était un solitaire dont la production littéraire fut absolument considérable,
si l’on en croit Diogène Laërte[2]
(IIIe siècle av. J.-C). Bien que Leucippe ait eu des idées atomistes avant lui,
Démocrite donna une complexité et une portée bien plus vastes à cette théorie
philosophique que ne le fit son maître.
Diogène
Laërte écrivit que Démocrite disposait d’un savoir encyclopédique, acquis — en
plus de ses voyages — de ses études incessantes dans une cabane (une
« cellule ») qu’il s’était construite dans son jardin à cet effet[3].
Mathématiques, physique, médecine, botanique, zoologie, éthique, etc, il possédait
de vastes connaissances et aurait rédigé un grand nombre d’ouvrages et de
traités sur ces thématiques mais aussi sur l’agriculture, la chose militaire,
etc. C’est pour cette raison que les habitants d’Abdère le surnommaient Sophia (le philosophe)[4].
Voilà
pour le personnage — ou en tout cas l’image qu’on en avait à son époque. Mais
qu’en est-il de cette théorie atomiste qu’il avait apprise de son maître
Leucippe, et développée de ses propres réflexions ?
Les
réflexions sur la matière allaient bon train chez les philosophes grecs durant
l’Antiquité. La question de la nature de la matière, inaccessible
expérimentalement à cette époque, était débattue du point de vue de la
philosophie. Au Ve siècle av. J.C., Empédocle (490-430 av. J.-C.) fut le
premier dont on ait connaissance à considérer que toute matière est constituée
de combinaisons d’éléments fondamentaux, l’eau, l’air, le feu et la terre[5].
Par « éléments fondamentaux », Empédocle signifiait que rien de plus
simple que ces corps-là n’existait et que tous les autres, toutes les
substances, étaient issues de mélanges de ces éléments fondamentaux, dont les
mélanges en proportions variées donnaient à tout corps matériel des caractéristiques
qui lui étaient propres. Ces quatre éléments constituaient les essences de base
de la matière et « [pouvaient] se
transformer l’un dans l’autre, sous leurs actions réciproques »[6].
Diogène de Laërte précise qu’Empédocle « admettait l'existence de quatre éléments : feu, eau, terre
et air, auxquels il ajoutait l'amitié qui réunit et la discorde qui divise »[7], autrement dit, que l’union des
éléments dépendait d’ « interactions » favorables (amitié) ou
répulsives (discorde), qu’on définirait plutôt aujourd’hui comme
« affinité » et « répulsion ». D’autres philosophes avaient
imaginé des systèmes ne faisant intervenir qu’un, deux ou trois éléments, comme
le signale Aristote (384-322 av. J.-C.) dans De la génération et de la corruption, dans laquelle il proposait sa
propre version de la théorie des quatre éléments[8].
En fait, chez les Grecs, il y avait cette idée que le fonds de la réalité était
simple et que de cette simplicité et
de ses combinaisons, émergeait la complexité et la diversité.
Comme
l’écrivent J. Lecomte et M. H. Marganne[9],
la théorie des quatre éléments visait chez les grecs à expliquer l’univers dans
son entièreté, c’est-à-dire qu’elle avait pour but de « concilier l’unité du macrocosme, l’univers,
et le microcosme, l’homme », de comprendre la Nature à toutes les
échelles à partir d’un petit nombre de principes et de constituants de base[10].
Ici, la Nature est à comprendre comme « commencement et fondement de la réalité du monde et des objets qu’il
renferme », donc comme le monde matériel tout entier. Aristote ajouta
aux éléments quatre qualités opposées[11][12]
(humide/sec, froid/chaud, etc.) censées rendre compte des changements possibles
entre les éléments lors de leurs associations[13].
Aristote ajouta aussi un cinquième élément, l’Ether (ou la quintessence, la
« cinquième essence »), seul constituant des corps célestes, un
élément ne subissant ni corruption, ni altération, et qui ne pouvait naître à
partir des quatre autres[14]
et se déplaçait uniquement par mouvement circulaire.
L’idée de l’entité
insécable
Mais
les atomes étaient des idées. Par l’argumentation, par des arguments logiques,
on proposait que la matière fût en
principe constituée de corpuscules fondamentaux insécables. C’était l’idée
de Démocrite. Mais elle fut rejetée pendant plus de deux mille ans. Je ne vais
pas ici te raconter l’histoire de l’idée de l’atome ou la manière dont on l’a
découvert, ce serait beaucoup trop long, et pas du tout le propos. Je veux juste
te faire comprendre que l’idée d’une matière possédant des constituants
fondamentaux insécables a vu le jour bien
avant que des preuves de cette réalité n’existent. Je veux aussi insister
sur le fait que, dans le principe, les atomes
des philosophes grecs étaient insécables,
les parties ultimes de la matière. Ce
que nous appelons atomes aujourd’hui
ne correspond pas du tout à cette définition, puisqu’ils sont, en réalité, eux
aussi constitués de parties plus petites. En fait, on pensait les atomes
fondamentaux (non composés d’autre chose) parce que les opérations chimiques qu’on
peut leur faire subir ne permettaient pas de les résoudre en entités plus petites.
Permets-moi
de reproduire ici un passage d’un billet antérieur (que tu peux trouver ici) :
Un élément (un atome) restait une entité que l’on ne pouvait pas
décomposer par l’analyse. Mais avec la physique moderne, il devint possible
de « casser » les atomes, et on se rendit compte qu’il s’agissait d’entités
composites. Mais il existe bien des entités plus petites qui, pour l’instant,
semblent fondamentales, c’est-à-dire
qui semblent bel et bien insécables. On les appelle les particules élémentaires.
L’idée de particule élémentaire
Tu
noteras, cher lecteur, que le vocabulaire compte beaucoup. Ce qu’on appelle particule, ici, est une entité physique
à la taille extrêmement réduite — si la taille de ces objets aux propriétés
ondulatoires/quantiques a encore un sens. Elles sont, quoi qu’il en soit, plus
petites que des atomes, et souvent désignées par le terme qualificatif
« subatomiques » (sous la taille de l’atome). Lorsqu’un physicien
parle de particules, il se réfère en général à ces entités-là. Mais dans
d’autres disciplines, « particule » peut désigner simplement
« quelque chose de petit » par rapport aux autres objets étudiés.
Lorsqu’un biologiste parle de « particules alimentaires », il se
réfère à des fragments ou des débris qu’un animal peut consommer, et qui sont
beaucoup plus petits que lui ; mais dans ce cas, « particule »
ne désigne pas du tout des entités subatomiques. Il en est de même lorsqu’un
astrophysicien ou un météorologue parlent de particules de poussière, qui
désignent des amalgames de matière beaucoup, beaucoup plus gros que des particules fondamentales mais nettement
plus petits que des planètes, des météorites ou des micrométéorites.
En
d’autres termes, le mot « particule » possède beaucoup de sens
différents dans le langage commun. Dans le champ scientifique, la thématique
d’un article scientifique et les échelles d’étude permettent de lever le doute
sans aucun problème, mais un non-spécialiste qui découvrirait un texte
professionnel serait en droit de se demander de quel genre de
« particules » on parle. Tu vas me dire que c’est assez évident en
lisant un texte scientifique, mais sache que ce genre d’ambiguïtés fait souvent
le lit des charlatans et des pseudosciences qui les utilisent sans vergogne
pour donner à un discours sans aucun fondement une apparence professionnelle.
C’est souvent le cas avec le jargon de la physique quantique, d’ailleurs.
Si
je m’attarde sur ce point de vocabulaire, c’est parce que pendant très
longtemps, la chimie utilisait les mots atomes, molécule, particule, comme des
synonymes pour désigner de « petites entités », de « petites
parties » d’un corps, des corpuscules. Lorsqu’on lit des textes du XIXe
siècle, et plus encore du XVIIIe siècle (comme ceux de Lavoisier), les auteurs
parlent tour à tour molécules, atomes, particules, etc, comme des synonymes. Le
vocabulaire n’était pas encore fixé par convention. De nos jours, « molécule »
désigne un assemblage d’atomes, mais ce n’était pas le cas du temps de
Lavoisier ou de ses successeurs, jusqu’au début du XXe siècle. A cette époque,
on parlait également d’éléments,
qu’on a tendance aujourd’hui à traduire par « atome », mais qui, dans
la pensée des chimistes de cette époque avait un sens très différent du concept
moderne d’atome. Je crois intéressant de voir ce que ces explorateurs du monde
de l’infiniment petit entendaient par « élément », et tu verras que
c’est subtilement différent de la notion d’atome insécable tel que
l’envisageaient les atomistes grecs tels que Démocrite, ou nous, aujourd’hui.
La matière vue depuis notre époque, après moult découvertes
La
matière ordinaire est dite « baryonique » (tu verras juste après
pourquoi) et elle représente à peine 4,9 % de la matière de l’Univers, le reste
étant composé de matière noire (26,8 %) et d’énergie noire (68,3 %) qui ne sont
pas directement observables, mais dont on peut mesurer les effets. La matière
noire et l’énergie noire n’ont pas encore été formellement caractérisées à
l’heure actuelle, et on ne sait pas avec certitudes si l'une et/ou l'autre sont réelles, ou si elles correspondent à d'autres phénomènes encore mal compris.
De
quoi est composée la matière ordinaire ?
La matière est apparue après le
Big Bang, c’est-à-dire l’évènement survenu il y a 13,7 milliards d’années et
qui a déclenché l’expansion de l’univers. A mesure que l’univers se dilatait et
se refroidissait les particules
élémentaires sont apparues à partir du vide quantique. Parmi elles, les fermions,
des particules possédant une masse,
et qui sont subdivisées en deux sous-familles : (1) les leptons et (2) les quarks.
 |
| Particules élémentaires
et particules composées. Les particules élémentaires comportent plusieurs
familles, dont les fermions, qui contiennent deux sous-familles : les
leptons (neutrinos, électron, muon et tau) dont les charges respectives sont
indiquées (-1 ou 0), et les quarks. Lorsque ces particules élémentaires se
combinent entre elles grâce à des interactions physiques, elles forment des
particules composites. Les baryons sont formés de 3 quarks. Parmi eux, on
compte le neutron (composé d’un quark « up » et de deux quarks
« down », udd) et le proton (uud). |
Les leptons regroupent plusieurs
types de neutrinos, qui sont des
particules avec une masse très faible et aucune charge électrique (elle est
donc neutre, d’où leur nom) et des particules possédant une charge électrique entière négative (en l’occurrence égale
à –1), tels que les électrons, les
particules « mu » (µ)
et « tau » (t). Les quarks, eux, sont des particules
possédant une masse, mais aussi des charges dites « non-entières »
(en l’occurrence, +2/3 ou -1/3). Lorsque l’univers s’est refroidi suffisamment,
ces particules élémentaires ont commencé à interagir entre elles, et à former
des particules composites plus grosses, telles que les hadrons, qui sont des assemblages de quarks. Parmi ces nouvelles
particules, les hadrons donc, on compte deux familles : (1) les mésons, dont on ne parlera pas ici, et (2)
les baryons. Ces derniers sont des
particules composites contenant toujours trois
quarks assemblés en différentes combinaisons. Selon les combinaisons
d’assemblage des 6 quarks possibles, on obtient tout un tas de particules dites
« baryoniques » dont, par exemple, le neutron et le proton. Ce
sont justement ces deux particules qui vont nous intéresser.
Le
proton et le neutron : en route vers les atomes
Le
proton et le neutron sont chacun constitués de 3 quarks ; ce sont donc des
baryons. Le neutron est composé de deux quarks « down » et un quark
« up » et ne possède pas de charge électrique. Le proton, lui, est composé de deux quarks
« up » et un quark « down » et possède une charge
électrique entière positive (ici +1). A mesure que l’univers se refroidissait,
les protons et les neutrons se sont aussi mis à interagir (là encore, grâce à
la force nucléaire forte, voir Encart 1),
et à former des structures plus grosses, qu’on appelle des noyaux. Les noyaux sont donc des assemblages de protons et de
neutrons, et, selon le nombre de protons et de neutrons, ils possèdent des
tailles et de propriétés différentes.
 |
| Description du texte de l'encart: Dans
la nature, il existe quatre forces fondamentales : la force gravitationnelle,
la force électromagnétique (EM), la force nucléaire faible (NFA) et la force
nucléaire forte (NFO). Ces forces permettent l’interaction entre deux objets ou
deux systèmes physiques. L’interaction
entre les quarks, au sein des baryons dépend de la force nucléaire forte. Elle
résulte de l’échange permanent, entre les quarks, de particules véhiculant
cette force, en l’occurrence les gluons (notés g). C’est également elle qui est
responsable de la cohésion (l’interaction) entre les protons et les neutrons
dans le noyau. Elle n’agit que sur des particules massives (avec une masse,
donc). La force nucléaire faible intervient dans le noyau, et est impliquée
dans les désintégrations radioactives. Elle est véhiculée par d’autres particules,
les bosons Z0, W+ et W-. La force électromagnétique, quant à elle, est
responsable de l’interaction entre les électrons et le noyau, et elle est
véhiculée par les photons (notés g, gamma). Toutes ces interactions
fondamentales sont décrites dans le cadre du modèle standard de la physique des
particules. L’exemple de la figure présente
l’interaction forte entre 3 quarks (deux «down», d et un «up», u) grâce à
l’échange permanent de gluons (orange, notés g) entre eux. Cette interaction
maintient les 3 quarks ensemble (elle les confine ensemble), ce qui donne
naissance au neutron (udd). Le même principe gouverne la formation du proton
(uud). L’interaction entre le noyau (chargé +) et l’électron (chargé -) dans un
atome nécessite l’échange de photons (g, gamma) qui maintient ces deux
particules fermement liées. Dans le jargon, on appelle ça des photons virtuels
(mais leur existence est réelle). |
Une
complication de charges
Dans la vie de tous les jours, on
dit que « les contraires s’attirent » et c’est une illustration
parfaite du comportement des objets chargés. Dans la nature, les particules de
charges opposées s’attirent, tandis que les objets dont les charges sont de
même nature se repoussent. Deux objets chargés négativement se repoussent, et
deux objets chargés positivement se repoussent également. C’est une propriété
de l’interaction électromagnétique (Encart 1).
 |
|
Interactions entre charges et architecture des noyaux. Les lois de l’électrostatique et de
l’électromagnétisme imposent que des charges opposées s’attirent et que des
charges identiques se repoussent. Dans les noyaux, les protons (chargés
positivement) ne pourraient pas s’assembler entre eux, car ils se
repousseraient, si les neutrons n’étaient pas présents. La présence des
neutrons et l’interaction forte assurent la cohésion des protons et de neutrons
et la stabilité des noyaux. Le noyau le plus simple est constitué d’un seul
proton (et pas de neutron), tandis que les noyaux plus complexes contiennent
des quantités croissantes de protons et de neutrons.
|
Le
noyau le plus simple est composé d’un seul proton, chargé positivement, et cela
ne pose guère de problèmes. Cependant, les noyaux plus complexes contiennent
plus d’un proton, et dès que deux protons se retrouvent proches l’un de
l’autre, ils devraient se repousser
et les noyaux devraient se désintégrer.
Or, on trouve des noyaux contenant 2, 3, 6, voire même des dizaines de protons,
mais qui sont, de manière contre-intuitive, stables. En fait, ils contiennent
aussi des neutrons (qui n’ont pas de
charge), et ce sont eux qui assurent la cohésion (la stabilité) du noyau et qui
empêchent que les protons ne se repoussent. Cette mise en commun de protons et
de neutrons fait appel à la force nucléaire forte (Encart 1).
Que sont
les atomes ?
Plus
l’univers se dilatait, et plus la température qui régnait diminuait, ce qui
signifie que la densité d’énergie diminuait elle aussi. Ce faisant, l’interaction électromagnétique put se manifester. L’une de ses conséquences fut
que les électrons (qui appartiennent à la famille des leptons, et qui sont
chargés négativement) ont pu interagir avec les noyaux, qui contiennent des
charges positives en raison de la présence de protons. L’assemblage d’un noyau
et d’électrons est un atome.
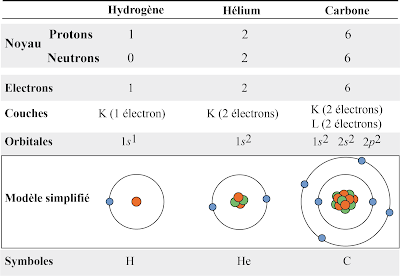
Tous les
atomes sont donc constitués de deux parties: un noyau autour duquel on trouve des électrons. Le noyau est composé de deux types de
particules subatomiques : les neutrons
et les protons. Ces deux types de
particules sont communément appelés les nucléons
(parce qu’ils se trouvent dans le noyau). Dans un atome, la cohésion
(stabilité) du noyau est assurée par la présence des neutrons, qui empêchent
les protons de se repousser entre eux à cause de leurs charges positives (qui
se repoussent entre elles).
 |
| Anatomie des atomes. La
figure présente la composition en protons et en neutrons de différents types
d’atomes (ici l’hydrogène, l’hélium et le carbone), ainsi que le nombre
d’électrons qui circulent autour de ces noyaux. Enfin, le symbole chimique de
chacun de ces atomes est donné (H pour hydrogène, He pour hélium et C pour
carbone). |
Les
atomes constituant la matière sont généralement neutres, autrement dit, ils
n’ont pas de charge électrique globale. Comment expliquer cela, alors que,
par exemple, les protons sont chargés positivement et les électrons
négativement ? Pour qu’un atome soit neutre, il faut qu’il y ait autant
d’électrons que de protons, de sorte que chaque électron (charge –1) compense
la présence d’un proton (charge +1) ! Et voilà !
Selon le
nombre de protons et de neutrons présents dans le noyau (et par extension, le
nombre d’électrons qui se trouvent autour
de ce noyau), on distingue plusieurs atomes différents. Ainsi :
· l’atome
le plus simple est constitué d’un proton et d’un électron. Son noyau ne
contient pas de neutron. Il s’agit de l’hydrogène
(symbole H).
· l’atome
suivant est plus complexe, et son noyau contient deux protons, deux neutrons et
est entouré de deux électrons : il s’agit de l’hélium (symbole He).
Vient
ensuite le lithium (symbole Li),
avec 3 protons, 4 neutrons, et 3 électrons, et ainsi de suite…, comme par
exemple le carbone (symbole C) avec
6 protons, 6 neutrons et 6 électrons. L’ensemble des atomes découverts dans la
nature sont classés dans le tableau de
classification périodique des éléments de Mendeleïev. Le terme
« élément » se réfère aux atomes.
On compte 118 éléments (atomes) dans ce tableau de classification.
 |
| Tableau de
classification périodique des éléments de Mendeleïev. Ce tableau classe tous
les atomes connus en fonction de leurs propriétés. Dans chaque ligne
horizontale (appelée période), les atomes sont classés de gauche à droite en fonction de leur masse, c’est-à-dire en
fonction du nombre croissant de
protons (Z) et de neutrons (n). Le nombre de protons (Z), qui est équivalent au
nombre d’électrons, est appelé numéro atomique, et le nombre N (avec N = Z + n)
le nombre de masse (tous les nucléons, c’est-à-dire protons et neutrons, qui déterminent la masse de
l’atome). Le tableau comporte 7 lignes et chacune d’entre elle représente une couche
électronique, ce qui signifie que les atomes de la ligne n°1 possèdent
uniquement une couche d’électrons, ceux de la ligne n°2 deux couches
d’électrons, etc. Les colonnes (verticales) de I à XVIII regroupent les atomes
dont les propriétés chimiques sont similaires. En fait, les électrons les plus externes
de ces atomes possèdent des configurations similaires (ce qui détermine la
similarité de leurs propriétés chimiques). Ainsi, lorsqu’on sait le manipuler,
ce tableau permet d’avoir une idée de la structure électronique des atomes, et
des propriétés qu’ils ont. |
En observant ces premiers atomes,
on remarque tout de suite que plus le noyau contient de protons et de neutrons,
plus le nombre d’électrons devient important (pour compenser les charges des
protons) et plus l’atome lui-même devient « gros ». Ainsi, un atome
de carbone (C) est plus « gros » qu’un atome d’hélium (He) qui est
lui-même plus « gros » qu’un atome d’hydrogène (H). De même, la masse
d’un atome de carbone est plus importante que celle d’un atome d’hélium et
qu’un atome d’hydrogène.
Comme le neutron et le proton
possèdent tous les deux une masse significative (1,67493x10-27 et
1,672622x10-27 kg respectivement), de même que l’électron (9,109x10-31
kg), alors l’assemblage de ces éléments, toujours plus nombreux, augmente la
masse globale d’un atome.
Dans
le tableau de classification périodique des éléments de Mendeleïev,
on classe les atomes par numéro atomique
croissant, c’est-à-dire par nombre de nucléons (protons + neutrons)
croissant et, par extension, par nombre d’électrons croissant. Autrement dit,
plus on avance (de gauche à droite et de haut en bas) dans le tableau, et plus
les atomes deviennent « lourds ».
Conclusion
Voilà, on a vu pas mal de choses
sur les particules élémentaires et sur les atomes, et dans l’épisode suivant,
on explorera la façon dont tout ce fourbi (protons, neutrons, électrons) sont « rangés »
à l’intérieur d’un atome, comment ces atomes sont organisés et comment cela
influence leurs propriétés et donc, à plus grande échelle, la manière dont ils
se comportent, la manière dont les réactions chimiques (et biochimiques) se
produisent dans tout l’univers.
REFERENCES
[4] Elien, Histoire variée, Op. cit.
[5] THERME Anne-Laure, « VII.
Empédocle », dans: Lire les présocratiques. sous la direction de
BRISSON Luc, MACE Arnaud, THERME Anne-Laure. Paris cedex 14, Presses
Universitaires de France, « Quadrige », 2012, p. 167-182. DOI :
10.3917/puf.briss.2012.01.0167.
[9] Lecomte, J. & Marganne, M.
H., op. cit., p. 15.
[10] Un courant philosophique qui
rappelle celui qui, plus tard, a influencé la science, qui chercha elle aussi à
expliquer la Nature en ne recourant qu’à des explications ancrées dans la
Nature comprise, comme par exemple chez Descartes, en tant que « monde
matériel » : « Sachez
donc, premièrement, que par la Nature je n'entends point ici quelque Déesse, ou
quelque autre sorte de puissance imaginaire, mais que je me sers de ce mot pour
signifier la Matière même en tant que je la considère avec toutes les qualités
que je lui ai attribuées comprises toutes ensemble, et sous cette condition que
Dieu continue de la conserver en la même façon qu'il l'a créée. »
(Descartes, Le Monde ou Traité de la lumière, T. XI, ch. VII, 1664)
[11] Aristote,
De la génération et de la corruption, livre II, chap. 3, 330-331a
[12] Aristote, Op. cit, livre II, chap. 3. Le texte est le suivant : « Comme il y a quatre éléments, et que les
combinaisons possibles, pour quatre termes, sont au nombre de six ; mais,
comme aussi les contraires ne peuvent pas être accouplés entre eux, le froid et
le chaud, le sec et l'humide ne pouvant jamais se confondre en une même chose,
il est évident qu'il ne restera que quatre combinaisons des éléments :
d'une part chaud et sec, chaud et humide ; et d'autre part, froid et sec,
froid et humide. Ceci est une conséquence toute naturelle de l'existence des
corps qui paraissent simples, le feu, l'air, l'eau et la terre. Ainsi, le feu
est chaud et sec ; l'air est chaud et humide, puisque l'air est une sorte
de vapeur ; l'eau est froide et liquide ; enfin, la terre est froide
et sèche. Il en résulte que la répartition de ces différences entre les corps
premiers se comprend très bien, et que le nombre des uns et des autres est en
rapport parfait »
[13] Aristote,
De la génération et de la corruption, livre II, chap. 4 et chap. 7.
[14] Aristote, Du ciel, Livre I, Chap. 2. Texte : « Il est de toute nécessité qu'il existe un corps simple dont la nature
soit de se mouvoir selon la translation circulaire, conformément à sa propre
nature… En dehors des corps qui nous entourent ici-bas, il existe un autre
corps, séparé d'eux, et possédant une nature d'autant plus noble qu'il est plus
éloigné de ceux de notre monde. »
![]() Ainsi, plus le nombre d’électrons
augmente, et plus le nombre d’orbitales augmente en « couches »
successives de plus en plus éloignées du noyau. Il y a donc des atomes qui ne
possèdent qu’une seule orbitale (1s
dans la couche K) comme l’hydrogène
(H) et l’hélium (He), qui en possèdent deux (1s et 2s) comme le lithium
(Li), ou encore trois (1s, 2s et 2p) comme le carbone (C) ou l’azote (N). La progression continue
pour les atomes qui possèdent davantage d’électrons : 1s, 2s,
2p, 3s, 3p, 3d, 4s,
4p, 4d, 4f, etc… Plus les
électrons sont nombreux, et plus ces orbitales se remplissent.
Ainsi, plus le nombre d’électrons
augmente, et plus le nombre d’orbitales augmente en « couches »
successives de plus en plus éloignées du noyau. Il y a donc des atomes qui ne
possèdent qu’une seule orbitale (1s
dans la couche K) comme l’hydrogène
(H) et l’hélium (He), qui en possèdent deux (1s et 2s) comme le lithium
(Li), ou encore trois (1s, 2s et 2p) comme le carbone (C) ou l’azote (N). La progression continue
pour les atomes qui possèdent davantage d’électrons : 1s, 2s,
2p, 3s, 3p, 3d, 4s,
4p, 4d, 4f, etc… Plus les
électrons sont nombreux, et plus ces orbitales se remplissent.